-
下列叙述中正确的是 ( )
A.离子化合物中可能含有共价键
B.共价化合物中可能含有离子键
C.共价化合物中可能不含极性键
D.金属离子一定是满足最外层2个电子或8个电子
难度: 中等查看答案及解析
-
化学已渗透到人类生活的各个方面。下列说法正确的是( )
A.光导纤维导电能力很强,是一种很好的通讯材料
B.氢氧燃料电池、硅太阳能电池都利用了原电池原理
C.在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀
D.禁止使用四乙基铅作汽油抗爆震剂,可减少汽车尾气污染
难度: 中等查看答案及解析
-
下列说法正确的是 ( )

难度: 中等查看答案及解析
-
室温下,各离子组一定能大量共存的是 ( )
A.强碱性溶液中:K+、Al3+、Cl—、SO2-4
B.pH=0的溶液中:Na+、Fe3+、NO—3、SO2—4
C.含有1mol·L-1Fe3+的溶液中:K+、Mg2+、I—、NO3
D.由水电离的c(H+)=1×10-14的溶液中:K+、Ca2+、Cl—、HCO3
难度: 中等查看答案及解析
-
实验室常利用以下反应制取少量氮气:NaNO2+NH4Cl=NaCl+N2↑+2H2O关于该反应的下列说法正确的是( )
A.NaNO2是氧化剂
B.N2既是氧化剂,又是还原剂
C.NH4Cl中的氮元素被还原
D.每生成1mol N2时,转移电子的物质的量为6mol
难度: 中等查看答案及解析
-
关于溶液中离子检验的说法正确的是 ( )
A.向溶液中加入澄清石灰水,溶液变浑浊,该溶液中一定含有CO23
B.向溶液中加入AgNO3溶液,生成白色沉淀,该溶液中一定含有Cl
C.向溶液中加入硝酸酸化的BaCl2溶液,生成白色沉淀,该溶液中一定含有SO24
D.向溶液中加入浓氢氧化钠溶液,加热,产生气体使湿润红色石蕊试纸变蓝,该溶液中一定含有NH+4
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是 ( )
A.氯化铁溶液与铁粉反应:Fe3++Fe=2Fe2+
B.NO2与水的反应:3NO2+H2O=2HNO3+NO
C.石灰石溶于醋酸:CaCO3+2CH3COOH=2CH3COO—+Ca2++CO2↑+H2O
D.氯化银悬浊液与KI溶液反应:Ag++I=AgI↓
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的数值,下列叙述正确的是 ( )
A.0.25mol Na2O2中含有的阴离子数为0.5N0
B.1mol α- 氨基乙酸(甘氨酸)分子中存在10N0对共用电子
C.标准状况下,2.24L CHCl3含有的分子数为0.1N0
D.足量铜与1L 18mol·L-1浓硫酸反应可以得到SO2的分子总数为9N0
难度: 中等查看答案及解析
-
下列除去杂质的方法中,正确的是 ( )
A.除去铜粉中混有的铁粉:加足量稀硝酸,过滤
B.除去N2中少量的CO2:通过足量灼热的CuO粉末
C.除去CO2中的少量的HCl:通过足量的饱和碳酸氢钠溶液
D.除去KCl溶液中的少量CaCl2:加适量Na2CO3溶液,过滤
难度: 中等查看答案及解析
-
已知下列热化学方程式:

由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l)的反应热△H为
A.+260.4kJ/mol B.-260.4kJ/mol C.-441.8kJ/mol D.+441.8kJ/mol
难度: 中等查看答案及解析
-
在25℃时,将a mol/L的醋酸溶液与0.01mol/L氢氧化钠溶液等体积混合,充分反应后溶液呈中性。下列说法不正确的是 ( )
A.a一定大于0.01
B.反应后溶液中一定有c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
C.反应后溶液中一定有c(CH3COO-)+c(CH3COOH)>c(Na+)
D.反应后溶液中一定有c(Na+)>c(CH3COO-)>c(H+)=c(OH)
难度: 中等查看答案及解析
-
下列各实验中,先产生沉淀,然后沉淀又溶解的是 ( )
①向饱和碳酸钠溶液中通入CO2至过量
②向氯化铝溶液中逐滴加入氢氧化钠溶液至过量
③向AgNO3溶液中逐滴加入氨水至过量
④向硅酸钠溶液中逐滴加入盐酸至过量
A.①② B.①③ C.①④ D.②③
难度: 中等查看答案及解析
-
常温时,下列关于电解质溶液的叙述正确的是 ( )
A.稀释pH=10的氨水,溶液中所有离子的浓度均降低
B.相同体积、相同浓度的盐酸与醋酸溶液,分别与同浓度的氢氧化钠溶液恰好完全反应时,醋酸消耗的氢氧化钠溶液体积多
C.pH=11的NaOH溶液和pH=11的氨水分别稀释100倍后的pH前者一定小于后者
D.分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多
难度: 中等查看答案及解析
-
铅蓄电池在现代生活中有广泛的应用。其电极材料是Pb和PbO2,电解质溶液是稀硫酸。下列说法正确的是 ( )
A.电池放电时,每消耗0.1molPb,共生成0.1molPbSO4
B.电池放电后,电池中溶液的pH变大
C.电池充电时,阴极反应为:Pb—2e—+SO2-4=PbSO4
D.电池充电时,把铅蓄电池的正极与外电源负极相连
难度: 中等查看答案及解析
-
有一溶液含有盐酸、硫酸、硝酸、硫酸铁、氯化铁、硝酸亚铁六种物质中的某两种,向该溶液中加入Ba(OH)2溶液,产生的沉淀与所加溶液关系如下图所示。
则该溶液的组成可能是( )
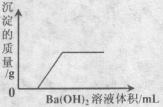
①酸、硝酸亚铁②盐酸、硫酸铁 ③硫酸、氯化铁 ④硝酸、氯化铁
A.② B.③ C.④ D.①④
难度: 中等查看答案及解析
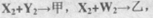 甲、乙可化合生成离子化合物丙。试回答下列问题:
甲、乙可化合生成离子化合物丙。试回答下列问题: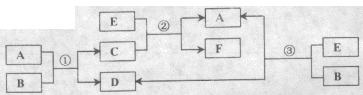
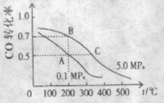
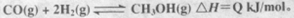 CO的转化率与温度、压强的关系如图所示。
CO的转化率与温度、压强的关系如图所示。