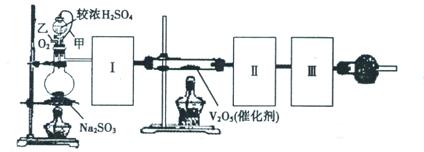
-
化学在日常生活和生产中有着重要的应用。下列说法不正确的有
①明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化;②生活中常用苏打作发酵粉;③氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂;④燃煤时加入适量石灰石,可减少废气中SO2的量;⑤常温下浓硫酸可以用铁制容器盛放;⑥工业上常用硅制造光导纤维
A.1个 B.2个 C.3个 D.4个
难度: 简单查看答案及解析
-
实验室保存下列药品的方法,正确的是
A.氢氟酸贮存在玻璃瓶里
B.实验室盛放浓硫酸的广口瓶应当用磨口玻璃塞,不能用橡皮塞
C.盛溴的试剂瓶里加一些水来防止溴挥发
D.氯水保存在无色玻璃瓶中;液氯贮存在钢瓶里
难度: 简单查看答案及解析
-
NA为阿伏伽德罗常数,下列说法正确的是
A.常温常压下,22.4L CO2中含有NA个CO2分子
B.17.6g丙烷中所含的极性共价键为4NA个
C.1.7g H2O2中含有的电子数为0.9 NA
D.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA
难度: 简单查看答案及解析
-
下列各组离子,一定能在指定环境中大量共存的是
A.在含有大量I-离子的溶液中:Cl¯、Fe3+、Al3+、Cu2+
B.滴加石蕊试液显红色的溶液:Fe2+、NH4+、Cl-、NO3-能够大量共存
C.在由水电离出的c(H+)=10-12 mol·L-1的溶液中:Na+、Ba2+、Cl¯、Br¯
D.在加入Al能放出大量H2的溶液中:NH4+、SO42¯ 、C1¯、HCO3¯
难度: 简单查看答案及解析
-
将足量CO2气体通入水玻璃(Na2SiO3溶液)中,然后加热蒸干,再在高温下充分灼烧,最后所得的固体物质是
A.Na2CO3、Na2SiO3 B.Na2CO3、SiO2 C. Na2SiO3 D.SiO2
难度: 简单查看答案及解析
-
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法正确的是
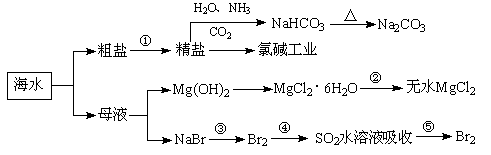
A.制取NaHCO3的反应是利用其溶解度小于NaCl
B.用澄清的石灰水可鉴别NaHCO3和Na2CO3
C.在第③、④、⑤步骤中,溴元素均被氧化
D.工业上通过电解饱和MgCl2溶液制取金属镁
难度: 简单查看答案及解析
-
把300ml有BaCl2和AlCl3的混合溶液分成3等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入等体积4bmol/L氢氧化钠溶液,恰好使产生的沉淀溶解。则该混合溶液中氯离子浓度为
A.20a/3 +b B.20a+3b C.2a+3b D.10a+2b
难度: 简单查看答案及解析
-
向Fe2O3、CuO、Fe、Cu的混和粉末中加入过量的稀硫酸,充分反应后,仍有红色粉末存在,则关于溶液中阳离子的判断正确的是
A.只有Fe2+和Cu2+ B.一定有Fe2+、Cu2+,可能有Fe3+
C.一定有Fe2+,可能有Cu2+ D.只有Fe2+
难度: 简单查看答案及解析
-
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是 ( )

A.还原剂是含CN-的物质,氧化产物只有N2
B.氧化剂是ClO- , 还原产物是HCO3-
C.配平后氧化剂与还原剂的化学计量数之比为5∶2
D.若生成2.24L N2(标准状况),则转移电子0.5 mol
难度: 简单查看答案及解析
-
如右图装置,将溶液A逐滴加入固体B中,下列叙述正确的是
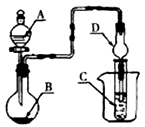
A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B.若A为醋酸,B为碳酸钙,C中盛澄清石灰水,则C中溶液变浑浊
C.若A为浓氨水,B为生石灰,C中盛A1C13溶液,则C中先产生白色沉淀,后沉淀又溶解
D.若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
难度: 简单查看答案及解析
-
将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入HCl气体6.72L(标准状况),若忽略反应过程中溶液的体积变化,则下列判断正确的是
A.最终得到7.8g的沉淀 B.反应过程中得到6.72L(标准状况)的气体
C.最终得到的溶液中c(NaCl)=2.0mo/L D.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
难度: 简单查看答案及解析
-
某无色溶液中可能含有①Na+、②Ba2+、③Cl-、④Br-、⑤SO32-、⑥SO42-中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
步骤
操作
现象
(1)
用pH试纸检验
溶液pH大于7
(2)
向溶液中滴加氯水,再加入CCl4振荡,静置
CCl4层呈橙色
(3)
向(2)所得的水溶液中加入
Ba(NO3)2和稀HNO3
有白色沉淀产生
(4)
过滤,向滤液中加入AgNO3溶液和稀HNO3
有白色沉淀产生
下列结论正确的是
A.肯定含有的离子是①④⑤ B.肯定没有的离子是②⑤
C.不能确定的离子是① D.不能确定的离子是③⑤
难度: 简单查看答案及解析
-
某实验小组对一含有Al3+的未知溶液进行了如下分析:(1)滴入少量氢氧化钠,无明显变化;(2)继续滴加NaOH溶液,有白色沉淀;(3)滴入过量的氢氧化钠,白色沉淀明显减少。实验小组经定量分析,得出如图所示沉淀与滴入氢氧化钠体积的关系。下列说法错误的是( )
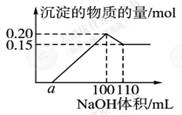
A.该未知溶液中至少含有3种阳离子
B.滴加的NaOH溶液的物质的量浓度为5 mol·L-1
C.若另一种离子为二价阳离子,则a=10
D.若将最终沉淀过滤、洗涤、灼烧,其质量一定为6 g
难度: 简单查看答案及解析
-
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
已知:2KMnO4+16HCl→2KCl+5Cl2↑+2MnCl2+8H2O

对实验现象的“解释或结论”正确的是
选项
实验现象
解释或结论
A
a处变蓝,b处变红棕色
氧化性:Cl2>Br2>I2
B
c处先变红,后褪色
氯气与水生成了酸性物质
C
d处立即褪色
氯气与水生成了漂白性物质
D
e处变红色
还原性:Fe2+>Cl-
难度: 简单查看答案及解析
-
铜有两种常见的氧化物CuO和Cu2O。某学习小组取0.98g(用精密天平测量)Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图1所示:另外,某同学绘制了三条表示金属氧化物与其所含金属元素的质量的关系曲线,如图2所示。则下列分析正确的是( )

A.图1中,A到B的过程中有0.01 mol电子发生了转移
B.图1整个过程中共生成0.26 g水
C.图2三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是A
D.图1中A和B化学式分别为Cu2O和CuO
难度: 简单查看答案及解析