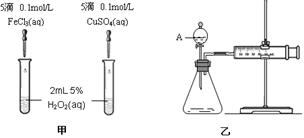
-
下列措施对增大反应速率明显有效的是 ( )
A.Al在氧气中燃烧生成A12O3,将Al片改成Al粉
B.Fe与稀硫酸反应制取H2时,改用浓硫酸
C.在K2SO4与BaCl2两溶液反应时,增大压强
D.Na与水反应时增大水的用量
难度: 中等查看答案及解析
-
在下列分子结构中,原子的最外层电子不能满足8电子稳定结构的是( )
A.CO2 B.PCl3 C.CCl4 D.NO2
难度: 中等查看答案及解析
-
19世纪门捷列夫的突出贡献是 ( )
A.提出了原子学说 B.发现了元素周期律
C.发现了稀有气体 D.提出了分子学说
难度: 简单查看答案及解析
-
下列各组物质中互为同位素的是 ( )
A.
和
B.D和T
C.H2O和H2O2 D.O3和O2
难度: 简单查看答案及解析
-
下列说法中错误的是 ( )
A.化学反应中的能量变化通常表现为热量的变化
B.化学键的断裂和形成是化学反应中能量变化的主要原因
C.需要加热才能发生的反应一定是吸热反应
D.反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量
难度: 中等查看答案及解析
-
下列物质中,只含有离子键,不含有共价键的是 ( )
A.Na2O2 B.KOH C.CaCl2 D.CO2
难度: 中等查看答案及解析
-
关于原子结构的叙述正确的是 ( )
A.所有的原子核都是由质子和中子组成的
B.原子的最外层电子数不超过8个
C.稀有气体原子的最外层电子数均为8
D.原子的次外层电子数都是8
难度: 中等查看答案及解析
-
同主族两种元素原子的核外电子数差值可能为 ( )
A.6 B.12 C.18 D.30
难度: 中等查看答案及解析
-
对于反应A2+3B2=2C来说,以下表示中,反应速率最快的是 ( )
A. v(B2)="0.8" mol/ (L·s) B. v(A2)="0.4" mol/ (L·s)
C. v(C)="0.6" mol/ (L·s) D. v(B2)="1.8" mol/ (L·s)
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A.决定化学反应速率的主要因素是参加反应的物质的性质
B.催化剂可以使不起反应的物质发生反应
C.可以找到一种催化剂使水变成油(油的成份为碳氢化合物的混合物)
D.催化剂是决定化学反应速率的主要因素
难度: 中等查看答案及解析
-
阴离子
含中子N个,X的质量数为A,a g X的氢化物中含质子的物质的量是( )
A.
mol B.
mol
C.
mol D.
mol
难度: 中等查看答案及解析
-
镍氢电池的总反应式是 H2+2NiO(OH)
2Ni(OH) 2根据此反应式判断,此电池放电时,负极上发生反应的物质是 ( )
A.NiO(OH) B.Ni(OH) 2 C.H2 D.H2和NiO(OH)
难度: 中等查看答案及解析
-
下列各组性质比较中,正确的是 ( )
①酸性:HClO4>HBrO4>HIO4 ②碱性:Ba(OH)2>Mg(OH)2>Be(OH)2
③氧化性:F>C>O ④还原性:Cl<S<Si
⑤气态氢化物稳定性:HF>HCl>H2S
A.①②③ B.②③④ C.①②④⑤ D.①②③④⑤
难度: 中等查看答案及解析
-
A、B、C都是金属,把A浸入C的盐溶液中,A的表面有C析出,A与B和酸溶液组成原电池时,B为电池的负极。A、B、C金属的活动性顺序为 ( )
A.A>B>C B.A>C>B C.B>A>C D.B>C>A
难度: 中等查看答案及解析
-
如果发现了原子序数为116的元素,下列对它的叙述中正确的是 ( )
①位于第7周期 ②非金属元素 ③最外电子层有6个电子 ④没有放射性 ⑤属于氧族元素 ⑥属于锕系元素
A.①③⑤ B.②④⑥ C.①③⑥ D.③④⑤
难度: 中等查看答案及解析
-
关于元素周期表,下列叙述中不正确的是( )
A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
B.在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素
C.在非金属元素区域可以寻找制备新型农药材料的元素
D.在地球上元素的分布和它们在元素周期表中的位置有密切关系
难度: 简单查看答案及解析
-
在一定温度下,反应A2(气)+B2(气)
2AB(气)达到平衡状态的标志是( )
A.单位时间里生成 n mol A2,同时生成 n mol AB
B.容器中的总压强不随时间而变化
C.A2、B2、AB的物质的量之比满足1:1: 2
D.单位时间里生成2n mol AB的同时生成n mol B2
难度: 中等查看答案及解析
-
在反应:C+CO2=2CO中,可使反应速率增大的措施是 ( )
①增大压强 ②升高温度 ③通入CO2 ④增加碳的量 ⑤降低压强
A.①②③ B.②③④⑤ C.①②③④ D.②③④
难度: 中等查看答案及解析
-
已知反应X+Y= M+N为吸热反应,对这个反应的下列说法中正确的是 ( )
A.X的能量一定低于M的,Y的能量一定低于N的
B.因为该反应为吸热反应,故一定要加热,反应才能进行
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.X和Y的总能量一定低于M和N的总能量
难度: 中等查看答案及解析
-
右图是氢氧燃料电池(电解质为KOH)构造示意图。关于该电池的说法不正确的是( )
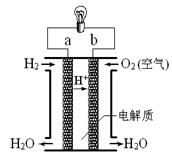
A.a极是负极
B.正极的电极反应是:O2+2H2O+4e-=4OH-
C.电子由b通过灯泡流向a
D.氢氧燃料电池是环保电池
难度: 中等查看答案及解析