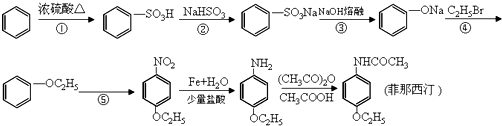
-
化学与社会生活密切相关,下列说法正确的是( )
A.PM2.5是指空气中直径≤2.5μm的颗粒物,直径为2.5μm的颗粒物分散在空气中形成胶体(1μm=10-6m)
B.甲壳素、棉花、铜氨纤维、涤纶、光导纤维都是有机高分子材料
C.有一种新发现的固态碳,称为“纳米泡沫”,外形似海绵,密度小,有磁性,这种碳与金刚石的关系是同素异形体
D.亚硝酸钠是有毒物质,不能添加到食物中
难度: 中等查看答案及解析
-
下列判断错误的是( )
A.将等物质的量浓度、等体积的Ba(OH)2溶液和NaHSO4溶液混合,生成白色沉淀:Ba2++SO42-+H++OH-=BaSO4↓+H2O
B.常温下,等物质的量浓度的三种溶液①(NH4)2CO3②NH4Cl③(NH4)2Fe(SO4)2中c(NH4+):①<②<③
C.加入苯酚显紫色的溶液中:K+、NH4+、Cl-、I-四种离子不能大量共存
D.c(H+)/c(OH-)=1×10-12的溶液:K+、AlO2-、CO32-、Na+四种离子可以大量共存
难度: 中等查看答案及解析
-
分子式为C5H12O的醇催化氧化得到的有机物不能发生银镜反应的醇有( )
A.8种 B.7种 C.5种 D.3种
难度: 中等查看答案及解析
-
利用实验仪器(规格和数量不限),能完成相应实验的一项是( )
选项
实验仪器(省略夹持装置)
相应实验
A
烧杯、玻璃棒、酒精灯
CuSO4溶液的浓缩结晶
B
蒸馏烧瓶、冷凝管、酒精灯
由工业酒精制无水酒精
C
天平、玻璃棒、胶头滴管、容量瓶
配制0.5mol•L-1的溶液100mL
D
烧杯、玻璃棒、胶头滴管、分液漏斗
用溴水和CCl4除去NaBr溶液中的少量NaI
难度: 中等查看答案及解析
-
常温下,在10mL0.1 mol•L-1Na2CO3溶液中逐滴加入0.1 mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )
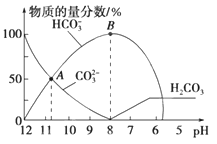
A.在0.1 mol•L-1 Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
B.当溶液的pH为7时,溶液的总体积为20 mL
C.在B点所示的溶液中,浓度最大的阳离子是Na+
D.在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-)
难度: 极难查看答案及解析
-
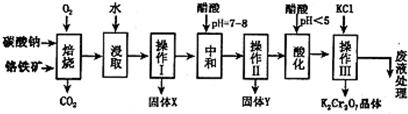
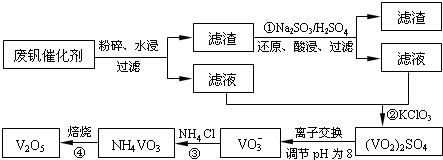
根据下列框图,有关说法正确的是( )

A.M、E都是第四周期中的过渡元素,E的金属活动性比M的金属活动性强,E3+的氧化性比M2+的氧化性弱
B.反应⑤的离子方程式可表示为:2E(OH)3+3Cl2+6H2O═3EO42-+6Cl-+12H+
C.反应①、②、③、⑤都属于氧化还原反应,且在反应①和③中硫酸仅表现了酸性
D.用K2EO4、Zn可制成一种高能电池,该电池中负极的电极反应式为:EO42-+4H2O+3e-═E(OH)3+5OH-
难度: 极难查看答案及解析
-
已知HCO3-+AlO2-+H2O=CO32-+Al(OH)3↓;将足量的KHCO3溶液不断滴入含等物质的量的KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与滴入的KHCO3溶液体积的关系可表示为( )
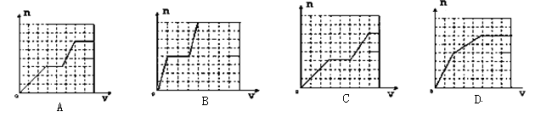
难度: 极难查看答案及解析