-
近期我国中东部地区发生持续雾霾天气,“PM2.5”数据监测纳入公众视野.PM2.5是指大气中直径小于或等于2.5微米(1微米=10-6米)的可入肺的有害颗粒.下列有关说法中不正确的是( )
A.PM2.5表面积大能吸附大量的有毒、有害物质
B.PM2.5在空气中形成了气溶胶
C.研制开发燃料电池汽车,降低机动车尾气污染,某种程度可以减少PM2.5污染
D.PM2.5主要业自工业生产、汽车尾气排放等过程中经过燃烧而排放的残留物,大多含有重金属等有毒物质难度: 中等查看答案及解析
-
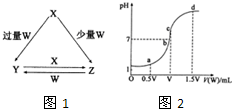
室温下,向amo1•L-1氨水中逐滴加入盐酸,下列描述不正确的是( )
A.溶液的pH减小
B.增大
C.水的电离程度先减小后增大
D.Kb不变难度: 中等查看答案及解析
-
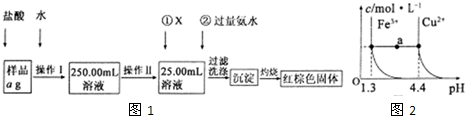
设NA为阿伏伽德罗常数的值,下列说法中正确的是( )
A.常温常压下,11.2L的NO2和CO2混合气体含有NA个O原子
B.标准状况下,22.4L的乙烯中含有的共用电子对数为12NA
C.1L0.1mo1•L-1的氨水中含有0.1NA个OH-
D.以石墨为电极电解氯化铜溶液时,若阳极上失去电子NA个,则阴极质量增加32g难度: 中等查看答案及解析
-
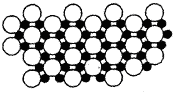
如图是四种常见有机物的比例模型示意图.有关下列说法正确的是( )
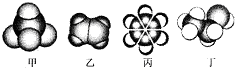
A.甲能使酸性KMnO4溶液褪色
B.乙可与溴水发生取代反应而使溴水褪色
C.丙与浓硫酸、浓硝酸的混合液共热发生取代反应
D.丁在稀硫酸作用下可与乙酸发生取代反应难度: 中等查看答案及解析
-
N、O、Si、S是重要的非金属元素,下列说法正确的是( )
A.N、O、S、Si的原子半径逐渐增大,非金属性逐渐减弱
B.氮的氧化物和硫的氧化物既是形成光化学烟雾,又是形成酸雨的主要物质
C.S、SO2和Si、SiO2四种物质均能与NaOH溶液反应,各自又能与某些酸反应
D.N、Si、S的单质均能和氧气反应,生成的产物分别是NO2、SiO2和SO2难度: 中等查看答案及解析
-
下列有关实验的说法正确的是( )
A.用pH试纸蘸取NaOH溶液,立刻与比色卡对比,测定NaOH溶液的pH
B.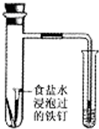 通过观察图中导管水柱的变化,验证铁钉生锈的原因主要是吸氧腐蚀
通过观察图中导管水柱的变化,验证铁钉生锈的原因主要是吸氧腐蚀
C.均不能采取将溶液直接蒸干的方法制得AlC13、A12(SO4)3、FeC13、Fe2(SO4)3
D.滴定用的滴定管、锥形瓶和配制一定物质的量浓度溶液用的容量瓶,使用前均要润洗难度: 中等查看答案及解析
-
短周期元素A、B、C在周期表中所处的位置如表所示.A、B、C三种元素原子的质子数之和为32,D元素原子的最外层电子数为次外层电子数的2倍.则下列说法正确的是( )
A C B
A.元素D形成的气态氢化物的分子构型一定是正四面体
B.A、B两种元素的气态氢化物均能与它们的最高价氧化物对应的水化物发生反应,且反应类型相同
C.在DB2、BC6、DC4的分子中,每个原子都满足8电子稳定结构
D.四种元素形成的气态氢化物中,C元素形成的氢化物的稳定性最高难度: 中等查看答案及解析