-
生活中的一些问题常涉及到化学知识,下列叙述不正确的是 ( )
A.维生素C具有还原性,在人体内起抗氧化作用
B.“加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子
C.日本大地震后,防疫人员在震区周围撒石灰,进行环境消毒,防止灾后出现疫情
D.为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入硫酸亚铁
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是 ( )
A.标准状况下,18gD2O中所含的质子数为10NA
B.标准状况下,11.2LO2参加反应转移的电子数一定为2 NA
C.28gN2和CO的混合气体中含有的分子数为NA
D.5.6g铁与足量稀硫酸反应失去电子数为0.3 NA
难度: 中等查看答案及解析
-
下列有关物质的分类或归类中正确的是( )
A.化合物:HT、CaCl2、NaOH、盐酸
B.纯净物:水玻璃、胆矾晶体、液氯、硫酸
C.天然高分子化合物:淀粉、纤维素、蛋白质、聚氯乙烯
D.同分异构体:CH3CH2CH2CH2CH3、CH3CH2CH(CH3)2、C(CH3)4
难度: 中等查看答案及解析
-
下列有关NaClO和NaCl混合溶液的叙述正确的是( )
A.该溶液中,H+、NH4+、SO42-、Br-可以大量共存
B.该溶液中,Ag+、K+、NO3-、CH3CHO可以大量共存
C.向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+ = Cl-+2Fe3++H2O
D.向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个
难度: 中等查看答案及解析
-
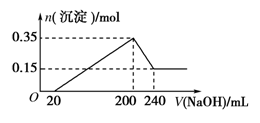
①1 L 0.1 mol/L的Na2CO3溶液中逐滴加入240 mL 0.5 mol/L的盐酸;②在240 mL 0.5 mol/L的盐酸中逐滴加入1 L 0.1 mol/L的Na2CO3溶液。两种实验操作在相同状态下产生CO2气体的体积( )
A.相等 B.前者多 C.后者多 D.无法判断
难度: 困难查看答案及解析
-
为了比较铁和铜金属活动性强弱,某研究小组的同学设计了如下一些方案,并将实验结果记录如下:
方案
现象或产物
①将铁片置于CuSO4溶液中
铁片上有亮红色物质析出
②将铁丝和铜丝分别在氯气中燃烧
产物分别为FeCl3和CuCl2
③将铁片和铜片分别放入热浓硫酸中
产物分别为Fe2(SO4)3和CuSO4
④将铁片和铜片分别放入稀硫酸中
铁片上有气泡,铜片上不产生气泡
⑤将铁片和铜片同时插入盛有稀硫酸的烧杯中,并用导线连接
铁片溶解,铜片有气泡产生
能根据以上各种现象或产物证明铁的金属活动性比铜强的方案一共有 ( )
A.2种 B.3种
C.4种 D.5种
难度: 困难查看答案及解析
-
向含SO42-、Fe2+、Br-、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是( )
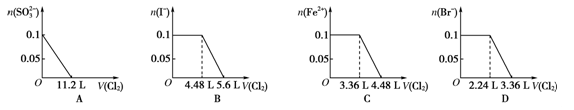
难度: 困难查看答案及解析