-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,18gD2O中所含的质子数为10NA
B.标准状况下,11.2LO2参加反应转移的电子数一定为2 NA
C.28gN2和CO的混合气体中含有的分子数为NA
D.5.6g铁与足量稀硫酸反应失去电子数为0.3 NA
难度: 中等查看答案及解析
-
生活中的一些问题常涉及到化学知识,下列叙述不正确的是
A.维生素C具有还原性,在人体内起抗氧化作用
B.“加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子
C.日本大地震后,防疫人员在震区周围撒石灰,进行环境消毒,防止灾后出现疫情
D.为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入硫酸亚铁
难度: 中等查看答案及解析
-
下列事实,不能用勒夏特列原理解释的是
A.溴水中有平衡:Br2+H2O
HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅
B.合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施
C.高压比常压有利于合成SO3的反应
D.对CO(g) + NO2 (g)
CO2 (g)+ NO(g) 平衡体系增大压强可使颜色变深
难度: 中等查看答案及解析
-
下述转化关系可用于合成解痉药奥昔布宁的前体(化合物丙)。

下列说法正确的是
A.化合物甲的分子式为C10H10O3,分子中的含氧官能团有醛基和酯基
B.化合物乙能发生消去反应,且生成的有机物能和溴发生加成反应
C.化合物乙与NaOH水溶液在加热条件下反应生成化合物丙
D.化合物丙能和氯化铁溶液发生显色反应
难度: 中等查看答案及解析
-
下列说法中,正确的是
A.已知25℃时NH4CN水溶液显碱性,则25℃时的电离平衡常数K(NH3·H2O)>K(HCN)
B.25℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL0.01 mol·L-1NH4Cl溶液中的Ksp小
C.pH试纸测得新制氯水的pH为4.5
D.FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3
难度: 中等查看答案及解析
-
碱性电池有容量大,放电电流大的特点,被广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn + 2MnO2 + H2O=Zn(OH)2+Mn2O3。下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为2MnO2 + H2O+2e-==Mn2O3 + 2OH-
C.外电路中每通过0.2mol电子,锌的质量理论上减少13g
D.电池工作时,电子由负极通过外电路流向正极
难度: 中等查看答案及解析
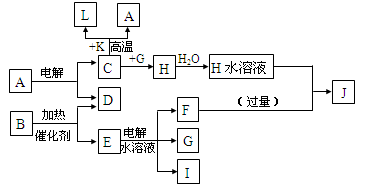
 ,它可通过不同化学反应分别制得B、C和D三种物质。
,它可通过不同化学反应分别制得B、C和D三种物质。


 (-R1、-R2表示氢原子或烃基);
(-R1、-R2表示氢原子或烃基);