-
化学与生活、科学、技术、社会、环境密切相关,下列有关说法中错误的是
A .高纯硅可作计算机芯片的材料
B.洁厕灵的主要成分是盐酸,不能与“84”消毒液(主要成分是NaClO)混用
C.PM2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体
D.Na2SiO3溶液可做木材防火剂
难度: 简单查看答案及解析
-
下列表示氯及其化合物的化学用语正确的是
A.中子数为20的氯原子符号:20Cl
B.HClO的结构式:H—Cl—O
C.HClO4的电离方程式:HClO4
H++ClO4-
D.Cl-的结构示意图:

难度: 简单查看答案及解析
-
除去下列物质中所含的杂质,选用的试剂正确的是
选项
物质(杂质)
试剂
A
Al2O3(SiO2)
NaOH溶液
B
CO2(SO2)
Na2CO3溶液
C
NO(NO2)
水
D
NaHCO3(Na2CO3)
Ca(OH)2溶液
难度: 中等查看答案及解析
-
探究浓硫酸和铜的反应,下列装置或操作正确的是

A.用装置甲进行铜和浓硫酸的反应
B.用装置乙收集二氧化硫并吸收尾气
C.用装置丙稀释反应后的混合液
D.用装置丁测定余酸的浓度
难度: 简单查看答案及解析
-
下列实验误差分析错误的是
A.用润湿的pH试纸测稀碱溶液的pH,测定值偏小
B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C.用标准液滴定待测液,滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D.中和热测定实验中,将碱缓慢倒入酸中,所测温度值偏小
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,3.4gH2O2含有极性键的数目为0.2NA
B.1molCl2和足量氢氧化钠溶液充分反应,转移电子数目为2NA
C.电解精炼铜时,若转移了NA个电子,则阳极质量减小32g
D.标况下,11.2LSO3所含的分子数目为0.5NA
难度: 简单查看答案及解析
-
下列离子或分子能够在指定的分散系中大量共存的是
A.与铝反应生成大量氢气的溶液中:Mg2+、K+、HCO3-、NO3-
B.0.1mol/L的NaNO3溶液中:K+、I-、Cl-、SO42-
C.铁与稀硫酸反应后的溶液中:[Fe(CN)6]3-、NH4+、Cl-、NO3-
D.空气中:SO2、NO、N2、NH3
难度: 极难查看答案及解析
-
下列与NaHSO3溶液有关的离子方程式书写错误的是
A.NaHSO3溶液与FeCl3反应:HSO3-+2 Fe3++H2O=SO42-+2Fe2++3H+
B.NaHSO3溶液和足量Ca(OH)2溶液反应:Ca2++OH-+HSO3-=CaSO3↓+H2O
C.NaHSO3溶液和稀HNO3反应:HSO3-+H+=SO2↑+H2O
D.NaHSO3溶液和NaAlO2溶液反应:HSO3-+ AlO2-+H2O=SO32-+Al(OH)3↓
难度: 简单查看答案及解析
-
固体A的化学式为NH5,它的所有原子的最外层均满足2个或8个电子的稳定结构。则下列有关说法中错误的是
A.1mol NH5中含有5NA个N-H键(NA表示阿伏加德罗常数的值)
B.NH5中既有共价键又有离子键
C.NH5的电子式为

D.它与水反应的化学方程式为NH5+H2O═NH3•H2O+H2↑
难度: 简单查看答案及解析
-
下列说法正确的是
A.氢气的燃烧热为△H=-285.5kJ•mol-1,则电解水的热化学方程式为2H2O(l)
2H2(g)+O2(g) △H=+285.5k•Jmol-1
B.反应SO2(g)+2H2S(g)=3S(s)+2H2O(l)在常温下能自发进行,则该反应的△H<0
C.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) +3H2(g)═2NH3(g)△H=-38.6k•Jmol-1
D.由C(石墨,s)=C(金刚石,s) △H=+1.90 k•Jmol-1可知,金刚石比石墨稳定
难度: 中等查看答案及解析
-
化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是

A.根据图①可判断可逆反应A2(g)+3B2(g)
2AB3(g)的△H>0
B.图②表示压强对可逆反应2A(g)+2B(g)
3C(g)+D(s)的影响,乙的压强大
C.图③表示在含等物质的量NaOH、Na2CO3的混合溶液中逐滴加入0.1mol/L盐酸至过量时,产生气体的物质的量与消耗盐酸的体积关系
D.图④表示Cl2通入H2S溶液中pH变化
难度: 简单查看答案及解析
-
已知:NH3·H2O(aq)与H2SO4(aq)反应生成1mol正盐的△H=-24.2kJ•mol-1,强酸、强碱稀溶液反应的中和热为△H=-57.3kJ•mol-1,则NH3·H2O在水溶液中电离的△H等于
A.-69.4 kJ/mol B.-45.2kJ/mol C.+69.4 kJ/mol D.+45.2 kJ/mol
难度: 简单查看答案及解析
-
已知NH4CuSO3与足量的5 mol•L-1硫酸溶液混合微热,产生下列现象::①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色.据此判断下列说法正确的是
A.反应中硫酸作氧化剂
B.NH4CuSO3中硫元素被氧化
C.刺激性气味的气体是氨气
D.1mol NH4CuSO3完全反应转移0.5mol电子
难度: 简单查看答案及解析
-
氰(CN)2,硫氰(SCN)2等称为拟卤素,与卤素单质性质相似,它们的阴离子与也卤素阴离子性质相似,阴离子的还原性顺序为: Cl-<Br-<CN-<SCN-<I-,又知,拟卤素形成的无氧酸和含氧酸一般为弱酸,下列反应中,不合理的是
A.4HCN(浓)+MnO2
Mn(CN)2+(CN)2↑+2H2O
B.(CN)2+H2O=2H++CN-+CNO-
C.(CN)2+2OH-=CN-+CNO-+H2O
D.(CN)2+2SCN-=2CN-+(SCN)2
难度: 中等查看答案及解析
-
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是
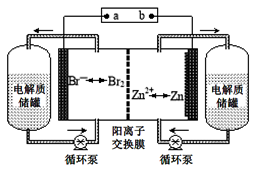
A.阳离子交换膜可阻止Br2与Zn直接发生反应
B.放电时正极的电极反应式为Br2+2e-=2Br-
C.充电时电极b连接电源的正极
D.放电时左侧电解质储罐中的离子总浓度增大
难度: 中等查看答案及解析
-
500mLKNO3和Cu(NO3)2的混合溶液中c(NO3-)为6.0 mol•L-1,用石墨电极电解此溶液,当通电一段时间后,两极均收到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是
A.原混合溶液中c(K+)为4mol/L
B.原溶液中c(Cu2+)为1mol/L
C.电解后溶液中c(H+)为8mol/L
D.电解后加入1molCu(OH)2可使溶液复原
难度: 简单查看答案及解析
-
2SO2(g)+O2(g)
2SO3(g) △H<0,400℃时体积相同的甲、乙、丙三个容器中,甲容器绝热恒容,充入2molSO2和1molO2,乙容器恒温恒容,充入2molSO3,丙容器恒温恒压,充入2molSO3,充分反应达到平衡,下列说法正确的是
A.甲和乙中反应的化学平衡常数相同
B.乙和丙中的二氧化硫的生成速率相同
C.乙中SO2的体积分数大于丙
D.转化率:α甲(SO2)+α乙(SO3)<1
难度: 中等查看答案及解析
-
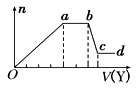
T℃时,在2L的密闭容器中,A气体与B气体发生可逆反应生成C气体,反应过程中A、B、C物质的量变化如下图(Ⅰ)所示。若保持其它条件不变,温度分别为T1和T2时,B的物质的量分数与时间关系如下图(Ⅱ)所示。下列叙述正确的是

A.2min内A的化学反应速率为0.1 mol/(L•min)
B.在反应达平衡时,保持其他条件不变,增大压强,正逆反应速率都增大,且平衡向逆反应方向移动
C.在反应达平衡时,其他条件不变,升高温度,正逆反应速率都增大,且A的转化率增大
D.图(I)中,达平衡时,A的体积分数为37.5%
难度: 简单查看答案及解析
-
某无色稀溶液X中,可能含有如表所列离子中的某几种。
阴离子
CO32- 、SiO32-、AlO2- 、Cl-
阳离子
Al3+、Fe3+、Mg2+、NH4+ 、Na+
取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示
 下列说法正确的是
下列说法正确的是A.若Y是盐酸,则X中一定含有CO32-、SiO32-、AlO2-和Na+
B.若Y是NaOH溶液,则X中一定含有Al3+、Fe3+、NH4+、Cl-
C.若Y是NaOH溶液,则ab段发生反应的离子方程式为:NH4++OH-=NH3↑+H2O
D.若Y是NaOH溶液,则X中的Al3+、Mg2+、NH4+ 物质的量之比为1:1:2
难度: 困难查看答案及解析
-
在1L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2 mol•L-1和1.5 mol•L-1,现向该溶液中加入39.2g铁粉使其充分反应,下列有关说法正确的是
A.反应后溶液中Fe3+物质的量为0.8 mol
B.反应后产生13.44 L H2(标准状况)
C.反应后溶液中Fe2+和Fe3+物质的量之和为0.9 mol
D.由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体
难度: 中等查看答案及解析
 图(Ⅰ)
图(Ⅰ) 图(Ⅱ)
图(Ⅱ)