-
主族元素原子失去最外层电子形成阳离子,主族元素原子得到电子填充在最外层形成阴离子。下列各原子或离子的电子排布式错误的是( )
A. Ca2+ 1s22s22p63s23p6 B. O2- 1s22s23p4
C. Fe 1s22s22p63s23p63d64s2 D. Fe2+ 1s22s22p63s23p63d6
难度: 中等查看答案及解析
-
以下电子排布式是基态原子的电子排布的是( )
①1s12s1 ②1s22s12p1 ③1s22s22p63s2 ④1s22s22p63s23p1
A. ①② B. ①③ C. ②③ D. ③④
难度: 中等查看答案及解析
-
下列各组原子中,彼此化学性质一定相似的是( )
A. 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B. 原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C. 2p轨道上只有2个电子的X原子与3p轨道上只有2个电子的Y原子
D. 最外层都只有一个电子的X、Y原子
难度: 中等查看答案及解析
-
下列元素相关粒子的电子排布式中,前者一定是金属元素,后者一定是非金属元素的是( )
A. [Ne]3s1 [Ne]3s2 B. [Ar]4s1 [Ne]3s23p4
C. [Ne]3s2 [Ar]4s2 D. [He]2s22p4 [Ne]3s23p5
难度: 中等查看答案及解析
-
以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是( )
A.
B.
C. 1s2 D.
难度: 中等查看答案及解析
-
自从1803年英国化学家、物理学家道尔顿提出原子假说以来,人类对原子结构的研究不断深入、不断发展,通过实验事实不断地丰富、完善原子结构理论。请判断下列关于原子结构的说法正确的是( )
A. 所有的原子都含有质子、中子和电子三种基本构成微粒
B. 所有的原子中的质子、中子和电子三种基本构成微粒的个数都是相等的
C. 原子核对电子的吸引作用的实质是原子核中的质子对核外电子的吸引
D. 原子中的质子、中子和电子三种基本构成微粒不可能再进一步分成更小的微粒
难度: 中等查看答案及解析
-
下列各组指定的元素不能形成AB2型化合物的是( )
A. 1s22s22p2和1s22s22p4 B. 1s22s22p63s23p4和1s22s22p4
C. 1s22s22p63s2和1s22s22p5 D. 1s22s22p5和1s22s22p4
难度: 中等查看答案及解析
-
下列关于硅原子的核外电子排布表示式中,错误的是( )
A. 1s22s22p63s23p2 B. [Ne]3s23p2
C.
 D.
D. 
难度: 中等查看答案及解析
-
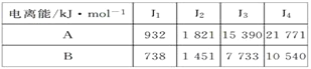
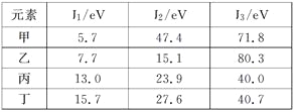
某元素的电离能如下,此元素位于元素周期表的族数是( )
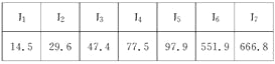
A. ⅡA B. ⅢA C. ⅤA D. ⅣA
难度: 中等查看答案及解析
-
下列能级中可容纳电子数最多的是( )
A. 6s B. 4p C. 3d D. 4f
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 同一原子中,1s、2s、3s电子的能量逐渐减小
B. 同一原子中,2p、3p、4p能级的轨道数依次增多
C. 能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动
D. 各能层含有的能级数为n(n为能层序数)
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.3p2表示3p能级有2个轨道
B.1s22s12p1表示的是激发态原子的电子排布
C.M能层中的原子轨道数目为3
D.处于同一轨道上的电子可以有多个,它们的自旋状态相同
难度: 简单查看答案及解析
-
下表中是A、B、C、D、E五种短周期元素的某些性质,下列判断正确的是( )
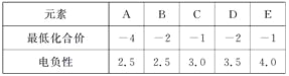
A. C、D、E的氢化物的稳定性:C>D>E
B. 元素A的原子最外层轨道中无自旋状态相同的电子
C. 元素B、C之间不可能形成化合物
D. 与元素B同周期且第一电离能最小的元素的单质能与H2O发生置换反应
难度: 中等查看答案及解析
-
下列各原子或离子的电子排布式或电子排布图表示正确的是( )
A. Ca2+:1s22s22p63s23p6 B. F-:1s22s23p6
C. P:最外层电子排布图为
 D. Cr:1s22s22p63s23p63d44s2
D. Cr:1s22s22p63s23p63d44s2难度: 中等查看答案及解析
-
下列有关光谱的说法中不正确的是( )
A. 原子中的电子在跃迁时会发生能量的变化,能量的表现形式之一是光(辐射),这也是原子光谱产生的原因
B. 原子光谱只有发射光谱
C. 通过原子光谱可以发现新的元素
D. 通过光谱分析可以鉴定某些元素
难度: 中等查看答案及解析
-
下列微粒的核外电子排布式书写违反泡利原理的是 ( )
A. C:1s22s22p2
B. Na+:1s22s22p43s2
C. S2-:1s22s22p23s23p4
D. K:1s22s22p63s23p7
难度: 简单查看答案及解析
-
某元素原子的原子核外有三个电子层,K层电子数为a,L层电子数为b,M层电子数为b-a,该原子核内的质子数是(
A. 14 B. 15 C. 16 D. 17
难度: 中等查看答案及解析
-
下列关于能层与能级的说法中正确的是( )
A. 同一原子中,符号相同的能级,其上电子能量不一定相同
B. 任一能层的能级总是从s能级开始,而且能级数不一定等于该能层序数
C. 同是s能级,在不同的能层中所能容纳的最多电子数是不相同的
D. 多电子原子中,每个能层上电子的能量一定不同
难度: 中等查看答案及解析
-
用高能
Mg核轰击
Cm核,发生核合成反应,得到新原子
Hs,该原子中中子数与核外电子数之差为( )
A. 161 B. 108 C. 84 D. 53
难度: 简单查看答案及解析
-
下列各组元素性质的递变情况错误的是( )
A. Na、Mg、Al原子最外层电子数依次增多
B. P、S、Cl元素最高正价依次升高
C. N、O、F第一电离能依次增大
D. Na、K、Rb电负性逐渐减小
难度: 中等查看答案及解析
-
玻尔理论、量子力学理论都是对核外电子运动的描述方法,根据对它们的理解,下列叙述中正确的是( )
A. 因为s轨道的形状是球形的,所以s电子做的是圆周运动
B. 3px、3py、3pz的差异之处在于三者中电子(基态)的能量不同
C. 钒原子核外有4种形状的原子轨道
D. 原子轨道和电子云都是用来形象地描述电子运动状态的
难度: 中等查看答案及解析
-
a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为
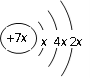 , b与c形成化合物的电子式为
, b与c形成化合物的电子式为 。下列比较中正确的是( )
。下列比较中正确的是( )A. 原子半径:a>c>d>b B. 电负性a>b>d>c
C. 原子序数:d>a>c>b D. 最高价含氧酸的酸性c>d>a
难度: 简单查看答案及解析
-
下列表示式错误的是( )
A. Na+的轨道表示式:
 B. Na+的结构示意图:
B. Na+的结构示意图:C. Na的电子排布式:1s22s22p63s1 D. Na的外围电子排布式:3s1
难度: 中等查看答案及解析
 ④Cr:1s22s22p63s23p63d44s2
④Cr:1s22s22p63s23p63d44s2