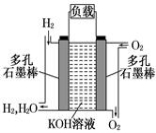
-
美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数118,中子数为175的超重
元素,该元素原子核内中子数与核外电子数之差是( )
A.57 B.47 C.61 D.293
难度: 简单查看答案及解析
-
下列反应属于吸热反应的是( )
A.碳与水蒸气制水煤气的反应
B.生石灰和水的反应
C.盐酸与氢氧化钠溶液的反应
D.木炭在氧气中燃烧
难度: 简单查看答案及解析
-
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期主族元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.增大压强,化学反应速率一定增大
B.化学反应速率为反应时间内反应物浓度的增加或者生成物浓度的减少
C.升高温度,化学反应速率一定增大
D.加入反应物,化学反应速率增大
难度: 中等查看答案及解析
-
能说明氯的非金属性比硫强的事实是( )
A.氯气与氢气反应生成氯化氢,而硫与氢气反应生成硫化氢
B.向硫化氢的水溶液中通入氯气可得到淡黄色的硫
C.氯气能与水反应而硫不能
D.氯原子最外电子层上有7个电子而硫最外电子层上有6个电子
难度: 简单查看答案及解析
-
已知a元素的阳离子,b元素的阴离子、c元素的阴离子具有相同的电子层结构,且b的阴离子半径大于c的阴离子半径,则其原子序数大小顺序为( )
A.c>b>a B.a>b>c C.a>c>b D.c>a>b
难度: 简单查看答案及解析
-
X、Y、Z是3种短周期元素,其中X、Y位于同一族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是( )
A.元素非金属性由弱到强的顺序为Z<Y<X
B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C.3种元素的气态氢化物中Z的气态氢化物最稳定
D.原子半径由大到小的顺序为Z<Y<X
难度: 中等查看答案及解析
-
纳米是长度单位,1纳米等于1×10-9米,物质的颗粒达到纳米级时,具有特殊的性质。例如将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜” 的有关叙述正确的是( )
A.常温下“纳米铜”比铜片的还原性强,反应时反应速率快
B.“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快
C.“纳米铜”与铜是同素异形体
D.常温下“纳米铜”比铜片更易得电子,反应时反应速率快
难度: 简单查看答案及解析
-
反应4A(g)+5B(g)== 4C(g)+ 6D(g)在某密闭容器中进行,半分钟后,C的物质的量浓度增加了0.3mol/L。下列论述正确的是( )
A.半分钟内的平均反应速率:5v(B)=6v(D) B.C的平均反应速率是0.010 mol·L-1·s-1
C.容器中含D的物质的量至少为0.45mol D.容器中A的物质的量浓度增加了0.3mol/L
难度: 中等查看答案及解析
-
下列有关原电池的说法中,正确的是( )
A.铝片和镁片用导线连接后插入NaOH溶液中,镁片较活泼,作负极
B.铝片和铜片用导线连接后插入浓硝酸中,铜作负极
C.镀锌铁和镀锡铁的镀层破损后,前者较易被腐蚀
D.将反应2Fe3++Fe=3Fe2+设计为原电池,则可用锌片作负极,铁片作正极,FeCl3溶液作电解质
难度: 中等查看答案及解析
-
下列各组顺序的排列不正确的是( )
A.原子半径:Na>Mg>Al>H B.热稳定性: HC l<H2S<PH3
C.酸性强弱:H2SiO3<H2CO3<H3PO4 D.氧化性:K+<Na+<Mg2+<Al3+
难度: 中等查看答案及解析
-
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是( )
A.由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-===AlO2-+2H2O
C.由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗铜电极32 g
D.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-===Cu2+
难度: 中等查看答案及解析
-
有A、B、C、D四种金属,将A与B用导线连接起来,浸入电解质溶液,B不易腐蚀。将A、D在稀盐酸中构成原电池,电流由A通过导线流向D。将铜浸入B的盐溶液中,无明显变化。如果把铜浸入C的盐溶液中,有金属C析出。这四种金属的活动性由强到弱的顺序是( )
A.DCAB B.DABC C.DBAC D.BADC
难度: 中等查看答案及解析
-
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。则下列说法正确的是( )
A.电池工作时,MnO2发生还原反应
B.电池负极的电极反应式为:2MnO2+H2O+2e-→Mn2O3+2OH-
C.电池工作时,K+移向负极
D.电池工作时,电路中每通过0.1mol电子,锌的质量理论上减少6.5g
难度: 中等查看答案及解析
-
下列说法中,不正确的是( )
A.双原子分子中的共价键,一定是非极性键
B.非极性键也可能存在于离子化合物中
C.分子间作用力,又叫范德华力,它比化学键要弱得多
D.共价化合物在液态时不能导电
难度: 简单查看答案及解析
-
某锂电池的电池总反应为4Li+2SOCl2=4LiCl+S+SO2,下列有关说法正确的是( )
A.锂电极作电池负极,放电过程中发生还原反应
B.1 mol SOCl2发生电极反应转移的电子数为4 mol
C.电池的正极反应为2SOCl2+2e-=4Cl-+S+SO2
D.组装该电池必须在无水、无氧的条件下进行
难度: 中等查看答案及解析
-
下列化学实验事实及其结论都正确的是( )
选项
实验事实
结论
A
将SO2通入含HClO的溶液中生成H2SO4
HClO的酸性比H2SO4强
B
铝箔在酒精灯火焰上加热熔化但不滴落
铝箔表面氧化铝熔点高于铝
C
稀、浓硝酸分别与铜反应,还原产物分别为NO和NO2
稀硝酸氧化性比浓硝酸强
D
将SO2通入溴水中,溴水褪色
SO2具有漂白性
难度: 简单查看答案及解析
-
将18 g铜和铁的混合物投入200 mL稀硝酸中,充分反应后得到标准状况下2.24 L NO,剩余9.6 g金属;继续加入200 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下2.24 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法中正确的是( )
A.原混合物中铜和铁各0.15 mol B.稀硝酸的物质的量浓度为1 mol·L-1
C.第一次剩余9.6 g金属为铜和铁 D.再加入上述200 mL稀硝酸,还会得到标准状况下2.24 L NO
难度: 困难查看答案及解析
-
下列有关化学用语的表示方法中正确的是( )
A.氯元素的原子结构示意图:
 B.N2的结构式:N≡N
B.N2的结构式:N≡NC.原子核内有8个中子的氧原子:
D.二氧化碳的电子式:
难度: 简单查看答案及解析
-
一定温度下,对于反应N2+O2
2NO在密闭容器中进行,下列措施能增大反应速率的是 ( )。
A.降低温度 B.恒容充入氮气 C.恒压充入氦气 D.恒容充入氦气
难度: 简单查看答案及解析
-
一定条件下,将A、B、C三种物质各1 mol通入一个密闭容器中发生反应:2A+B
2C,达到化学反应限度时,B的物质的量可能是( )
A.1.5 mol B.1 mol C.0.5 mol D.0
难度: 中等查看答案及解析
-
下列说法中正确的是 ( )
A.6.8 g固体KHSO4与3.9 g固体Na2O2中阴离子数目相同
B.常温下铁、铜均不溶于浓硫酸, 说明常温下铁、铜与浓硫酸均不反应
C.离子化合物中只含离子键
D.中子数为18的氯原子可表示为18Cl
难度: 中等查看答案及解析
-
已知反应4CO+2NO2
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
A.v(CO)=1.5 mol·L-1·min-1 B.v(NO2)=0.7 mol·L-1·min-1
C.v(N2)=0.4 mol·L-1·min-1 D.v(CO2)=1.1 mol·L-1·min-1
难度: 中等查看答案及解析
-
下图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )

A.A是反应物
B.前2 min A的分解速率为0.1 mol·L-1·min-1
C.前2 min C的生成速率为0.2 mol·L-1·min-1
D.反应的方程式为:2A(g)
2B(g)+C(g)
难度: 简单查看答案及解析
-
mA(g)+nB(g)
pC(g)+qQ(g)当m、n、p、q为任意整数时,达到平衡的标志是( )
①体系的压强不再改变 ②绝热体系的温度不再改变 ③各组分的浓度不再改变
④各组分的质量分数不再改变 ⑤反应速率vA: vB: vC: vD = m:n:p:q
⑥单位时间内m mol A断键反应,同时p mol C也断键反应
A.③④⑤⑥ B.②③④⑥ C.①③④⑤ D.①③④⑥
难度: 中等查看答案及解析