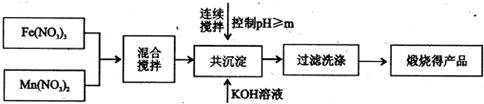
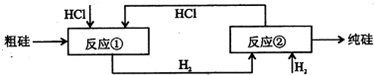
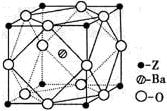
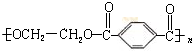
-
下列五种有色溶液与SO2作用,均能褪色,其实质相同的是( )
①品红溶液 ②酸性KMnO4溶液 ③溴水 ④滴有酚酞的NaOH溶液 ⑤淀粉-碘溶液.
A.①④
B.①②③
C.②③④
D.②③⑤难度: 中等查看答案及解析
-
分析如下残缺的反应:RO3-+__+6H+=3R2↑+3H2O.下列叙述正确的是( )
A.上式中缺项所填物质在反应中作氧化剂
B.RO3-中的R元素在所有的反应中只能被还原
C.R的原子半径在同周期元素原子中最小
D.R一定是周期表中的第ⅤA族元素难度: 中等查看答案及解析
-
下列说法错误的是( )
A.油脂、淀粉和蛋白质都是高分子化合物,它们在一定条件下都能水解
B.植物及其废弃物可制成乙醇燃料,它是一种可再生能源
C.含3个碳原子的有机物,每个分子中最多可形成3个C-C单键
D.石油的分馏是物理变化;石油的裂化和裂解以及煤的干馏都是化学变化难度: 中等查看答案及解析
-
下列说法正确的是( )
A.低碳生活倡导减少温室气体排放,CO2、CH4等是常见的温室气体
B.电解精炼铜时,当阳极质量减少3.2g时,转移的电子数为0.1×6.02×1023
C.已知反应mX(g)+nY(g)qZ(g),若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为1:1
D.C60的摩尔质量是720难度: 中等查看答案及解析
-
下列叙述中,正确的是( )
A.0.1mol•L-1CH3COOH溶液加水稀释时,所有离子的浓度都减小
B.NH4Cl溶液显酸性的原因:NH4++H2ONH3•H2O+H+
C.0.2mol•L-1盐酸与等体积0.05mol•L-1Ba(OH)2溶液混合后,溶液pH为1
D.25℃时pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7难度: 中等查看答案及解析
-
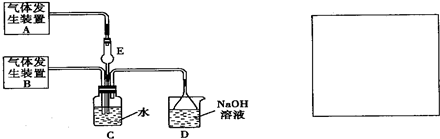
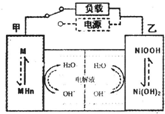
下列关于如图装置的说法错误的是( )
A.虚线框中若接灵敏电流计,则该装置可将化学能转化为电能
B.虚线框中若接直流电源,则该装置可能发生反应:Cu+H2SO4═CuSO4+H2↑
C.虚线框中若接直流电源,一段时间后,锌棒上可能镀铜
D.虚线框中无论是接灵敏电流计,还是接直流电源,当生成2.24LH2时一定转移0.2mole-难度: 中等查看答案及解析
-
在200mL含Mg2+、Al3+、NH4+、H+、Cl- 等离子的溶液中,逐滴加入5mol•L-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述不正确的是( )

A.x-y=0.01mol
B.原溶液中c(Cl-)=0.75mol•L-1
C.原溶液的pH=1
D.原溶液中n(Mg2+):n(Al3+)=5:1难度: 中等查看答案及解析