-
下列各组离子能在指定溶液中,能大量共存的是( )
①无色溶液中:K+,Cl-,Ca2+,CO32‑,SO42‑,NO3-
②pH=11的溶液中:CO32-,Na+,AlO2‑,NO3‑,S2-,SO32-
③水电离的H+浓度c(H+)=10-12mol•L-1的溶液中:Cl-,CO32-,NO3-,NH4+,SO32-
④加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl-,K+,SO42-
⑤使石蕊变红的溶液中:Fe2+,MnO4-,NO3-,Na+,SO42-
⑥中性溶液中:Fe3+,Al3+,NO3-,I‑,Cl‑,S2‑.
A.①②⑤
B.①③⑥
C.②④
D.①②④难度: 中等查看答案及解析
-
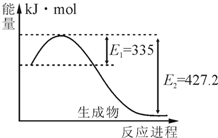
现有M、N、P、E四种元素,有以下反应:(1)在水溶液中,M+N2+═M2++N,(2)P+2H2O(l)═P(OH)2+H2↑,(3)N、E相连浸入稀H2SO4中,电极反应:N-2e-═N2+,2H++2e-═H2↑,判断元素的还原性由强到弱的顺序是( )
A.M、N、P、E
B.M、N、E、P
C.P、M、N、E
D.E、P、M、N难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
①常温常压下,9g甲烷(CH4)所含的中子数为5NA
②常温常压下,22.4L N2气体的分子数小于NA
③64g的铜发生氧化还原反应,一定失去2NA个电子
④常温常压下,100mL 0.5mol/L的乙酸溶液中,乙酸的分子数目小于0.05NA
⑤标准状况时,22.4L二氯甲烷所含有的分子数为NA
⑥常温常压下,1mol氦气分子含有的核外电子数为4NA.
A.①②
B.③④
C.②④
D.⑤⑥难度: 中等查看答案及解析
-
下列说法正确的是( )
A.最外层有4个电子的原子都是非金属原子
B.同一主族的两种元素的原子序数之差不可能是34
C.COCl2分子和CCl4分子中所有原子都满足最外层8电子结构
D.同主族金属的原子半径越大熔点越高难度: 中等查看答案及解析
-
下列实验操作示意图所示的实验操作正确的是( )
A.
加热结晶水合物
B.
镁条在二氧化碳里燃烧
C.
制备较纯净的HF
D.
红磷转变成白磷难度: 中等查看答案及解析
-
维生素E是一种脂溶性维生素,有抗衰老的特殊作用.维生素E有四种类型,其结构简式如图所示[R为(CH2)3CH(CH3)(CH2)3CH(CH3)(CH2)3CH(CH3)2].下列说法中,正确的是( )

A.四种维生素E均能与烧碱溶液反应
B.四种维生素E均能与溴水反应
C.四种维生素E互为同分异构体
D.四种维生素E均能在稀硫酸中水解难度: 中等查看答案及解析
-
将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合物液中滴加1mol•L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )
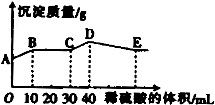
A.AB段发生反应的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B.BC段发生反应的离子方程式为:H++OH-=H2O
C.D点表示的沉淀的化学式为Al(OH)3、BaSO4
D.E点表示的溶液呈中性难度: 中等查看答案及解析