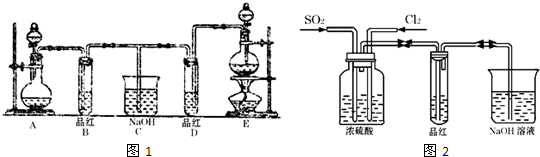
-
下列实验过程中,始终无明显现象的是( )
A.NO2通入FeSO4溶液中
B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中
D.SO2通入已酸化的Ba(NO3)2溶液中难度: 中等查看答案及解析
-
蒸馒头、炸油条时常用到一种白色物质,它既能中和发酵过程产生的酸,又能引起发泡作用,这种白色物质是( )
A.NaOH
B.NaHCO3
C.Ca(OH)2
D.NaCl难度: 中等查看答案及解析
-
高铁酸钾K2FeO4是一种新型、高效、氧化性比Cl2更强的水处理剂,工业上通常用下列反应先制得高铁酸钠:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,然后在某低温下,在高铁酸钠溶液中加KOH固体至饱和就可析出高铁酸钾,下列有关说法不正确的是( )
A.Na2O2在反应中既作氧化剂,又作还原剂
B.制取高铁酸钠时,每生成1molNa2FeO4反应中共有4mol电子转移
C.高铁酸钾在该温度下的溶解度比高铁酸钠的溶解度小
D.K2FeO4能消毒杀菌,其还原产物水解生成的Fe(OH)3胶体能吸附水中的悬浮杂质难度: 中等查看答案及解析
-
下列说法正确的是( )
A.向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色
B.欲除去氯气中少量氯化氢气体,可将此混合气体通过盛饱和食盐水的洗气瓶
C.漂白粉的有效成分是CaCl2和Ca(ClO)2,应密封保存
D.氯水经光照有气泡逸出,该气体为HCl难度: 中等查看答案及解析
-
下列叙述正确的是( )
①久置于空气中的氢氧化钠溶液,加硫酸时有气体产生
②浓硫酸可用于干燥氢气、氯化氢、碘化氢等气体,但不能干燥氨气、二氧化氮气体
③SiO2和CO2都是酸性氧化物,都能与强碱溶液反应,但不能与任何酸反应
④玻璃、水泥、水晶项链都是硅酸盐制品
⑤蔗糖炭化的演示实验中,浓硫酸既体现了其强氧化性又体现了其脱水性
⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得相同的物质.
A.①④⑤
B.①⑤⑥
C.②③④
D.④⑤⑥难度: 中等查看答案及解析
-
化学中常用类比的方法可预测许多物质的性质.如根据H2+Cl2=2HCl推测:H2+Br2=2HBr.
但类比是相对的,如根据2Na2O2+2CO2=Na2CO3+O2,类推2Na2O2+2SO2=Na2SO3+O2是错误的,应该是Na2O2+SO2=Na2SO4.
下列各组类比中正确的是( )
A.由Fe+S═FeS推测:Fe+Cl2═FeCl2
B.由2CO2+Ca(ClO)2+2H2O=Ca(HCO3)2+2HClO,推测:CO2+NaClO+H2O=NaHCO3+HClO
C.由CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO,推测:2SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO
D.由Na2SO3+2HCl=2NaCl+H2O+SO2↑,推测:Na2SO3+2HNO3=2NaNO3+H2O+SO2↑难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.实验室制备NH3可用NaOH固体和浓氨水为原料方便制得
B.二氧化硅是生产光纤制品的基本原料
C.工业制水泥、玻璃、陶瓷都要用到石灰石为原料
D.工业上可利用铝热反应原理制备高熔点金属难度: 中等查看答案及解析
-
下列关于钠的化学性质叙述:
①钠与水剧烈反应生成氢氧化钠和氢气; ②钠在空气中燃烧时生成白色固体过氧化钠; ③钠与盐酸反应时先与酸反应,过量的钠再与水反应; ④钠是金属,不溶于水也不和水反应; ⑤钠可从CuSO4溶液中置换出Cu.
以上叙述正确的是( )
A.④⑤
B.②③
C.①②
D.①③难度: 中等查看答案及解析
-
过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3•3H2O2,它具有Na2CO3和H2O2的双重性质.过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了还原反应的是( )
A.Na2SO3溶液
B.KMnO4溶液
C.稀盐酸
D.MnO2难度: 中等查看答案及解析
-
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
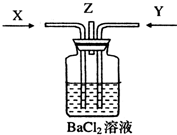
A.洗气瓶中产生的沉淀中有碳酸钡
B.在Z导管出来的气体中无二氧化碳
C.洗气瓶中产生的沉淀是硫酸钡
D.洗气瓶中无沉淀产生难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.NH4HCO3溶液与过量NaOH溶液反应:NH+4+OH-═NH3↑+H2O
B.铜溶解于稀硝酸中:Cu+4H++2NO-3═Cu2++2NO2↑+2H2O
C.向氨水中滴入盐酸:H++OH-═H2O
D.碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO-3+Ba2++OH-═BaCO3↓+H2O难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.元素由化合态变成游离态时,它可能被氧化,也可能被还原
B.SO2的水溶液能导电,所以SO2是电解质
C.难失电子的原子,得电子的能力一定强
D.在氧化还原反应中,有一种元素被氧化,肯定有另一种元素被还原难度: 中等查看答案及解析
-
下列实验操作或实验所得出的结论一定正确的是( )
A.加热NH4Cl晶体时,用湿润的红色石蕊试纸靠近试管口,检验NH3的生成
B.制备Fe(OH)3胶体时,应往沸水中逐滴加1mol•L-1的FeCl3溶液,并继续加热到液体呈透明的红褐色为止
C.将金属钠在研钵中研成粉末,使钠与水反应的实验更安全
D.用托盘天平准确称取5.85克NaCl难度: 中等查看答案及解析
-
关于如图所示实验装置及说法中正确的是( )
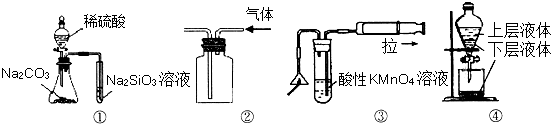
A.用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱
B.用图②所示实验装置排空气法收集CO2气体
C.用图③可以检验火柴燃烧生成的SO2气体
D.用图④提取海带中的碘难度: 中等查看答案及解析
-
在稀硫酸中加入铜粉,铜粉不溶,再加入下列固体粉末:①FeCl2;②Fe2O3;③Zn;④KNO3;⑤HCl;⑥H2O2;铜粉可溶解的是( )
A.①②⑤
B.①④⑥
C.②③⑤
D.②④⑥难度: 中等查看答案及解析
-
X元素的阳离子和Y元素的阴离子具有与氖原子相同的电子层结构,下列叙述正确的是( )
A.X的原子序数比Y的小
B.X原子的最外层电子数比Y的大
C.X的原子半径比Y的大
D.X元素的最高正价比Y的小难度: 中等查看答案及解析
-
300mL 2mol/L 硝酸与一定量的铝镁铁合金反应生成 3.36L NO (标准状况)和铁盐、铝盐、镁盐等,再向反应后的溶液中加入 3mol/L的NaOH 溶液,使铝镁铁元素恰好全部转化为沉淀,则所加 NaOH 溶液的体积是( )
A.150mL
B.200mL
C.450mL
D.无法计算难度: 中等查看答案及解析
-
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
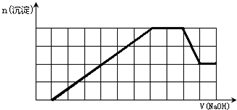
A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B.原溶液中一定含有SO42-和Na+
C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D.反应最后形成的溶液中含有的溶质为Na2SO4难度: 中等查看答案及解析