-
下列关于物质性质与应用的说法正确的是( )
A. 碳具有还原性,高温条件下能将二氧化硅还原为硅
B. 二氧化硫有漂白、杀菌性能,可在食品加工中大量使用
C. 二氧化硅是半导体材料,可将太阳能直接转化为电能
D. 二氧化锰具有较强的氧化性,可作H2O2分解的氧化剂
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 元素周期表中金属与非金属分界线附近的元素既具有金属性也具有非金属性,所以属于过渡元素
B. 第ⅠA族元素的金属性比第ⅡA族元素的金属性强
C. 若M+和R2-的核外电子层结构相同,则原子序数:R>M
D. 等物质的量的C2H6和H2O2含电子数相同
难度: 简单查看答案及解析
-
下列物质间的转化都能通过一步实现的是( )
A. Si→SiO2→H2SiO3→Na2SiO3 B. Al→Al2O3→NaAlO2→Al(OH)3
C. S→SO3→H2SO4→SO2 D. N2→NO2→HNO3→NO
难度: 中等查看答案及解析
-
对可逆反应:A(g)+B(s)
C(s)+D(g) ΔH>0。如图所示为正、逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:①加入A;②加入催化剂;③加压;④升温;⑤减少C,符合图示条件的是( )
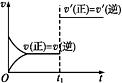
A. ②③ B. ①② C. ③④ D. ④⑤
难度: 中等查看答案及解析
-
在四个不同的容器中进行合成氨的反应。根据下列在相同时间内测定的结果,判断生成氨的速率最快的是( )
A. v(H2)=0.3 mol·L-1·min-1 B. v(N2)=0.05 mol·L-1·s-1
C. v(N2)=0.2 mol·L-1·min-1 D. v(NH3)=0.3 mol·L-1·min-1
难度: 中等查看答案及解析
-
下列说法或表示方法中正确的是( )
A. 对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
B. 等质量的硫蒸气和固态硫单质分别完全燃烧,后者放出的热量多
C. 表示氢气燃烧热的ΔH为-285.8 kJ·mol-1,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)
2H2O(l) ΔH=-285.8 kJ·mol-1
D. 已知中和热ΔH为-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ
难度: 中等查看答案及解析
-
下列物质露置于空气中易变质的是( )
①氯水 ②水玻璃 ③烧碱 ④漂白粉 ⑤绿矾 ⑥亚硫酸钠 ⑦浓硫酸 ⑧浓硝酸
A. ①②③④⑥⑧ B. ①⑤⑥⑦ C. ④⑤⑦⑧ D. ①②③④⑤⑥⑦⑧
难度: 中等查看答案及解析
-
在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)
2C(g) ΔH>0,其他条件不变化,只有温度变化时,某量随温度变化的关系如图所示。则下列说法中,正确是( )
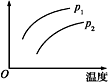
A. 若p1>p2,纵坐标表示A的质量分数
B. 若p1<p2,纵坐标表示C的质量分数
C. 若p1>p2,纵坐标表示混合气体的平均摩尔质量
D. 若p1<p2,纵坐标表示A的转化率
难度: 困难查看答案及解析
-
下列说法中正确的是( )
A. Na2O2分子中所有原子最外层均达到8电子稳定结构
B. NH4Cl、MgCl2均为离子化合物,均含有离子键和共价键
C. 同周期第ⅠA族元素和第ⅦA族元素之间只能形成离子化合物
D. NH4Cl仅由非金属元素组成,所以它是共价化合物
难度: 中等查看答案及解析
-
碳在氧气或臭氧中燃烧的能量变化如下图。下列说法不正确的是( )
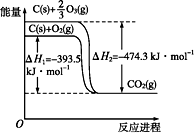
A. 3O2(g)
2O3(g) ΔH=+242.4 kJ·mol-1
B. 氧气比臭氧稳定,大气中臭氧层易被破坏
C. 断裂1 mol O2(g)中的共价键吸收的能量比形成1 mol CO2(g)中的共价键放出的能量少
D. 相同物质的量的氧气比臭氧所含的能量高
难度: 简单查看答案及解析
-
下列有关说法中不正确的是( )
①将盛有二氧化氮气体的试管倒立在水中,溶液会充满试管
②可用湿润的淀粉碘化钾试纸检验HCl中是否混有Cl2
③为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
④氨水中滴入酚酞溶液变红,是因为氨气能电离出氢氧根离子
⑤向蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
A. ①③④⑤ B. ②③④ C. ①③④ D. ①②⑤
难度: 中等查看答案及解析
-
二氧化硫的催化氧化原理为2SO2(g)+O2(g)
2SO3(g),反应混合体系在平衡状态时SO3的体积分数与温度的关系如图所示,下列说法错误的是( )
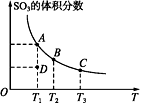
A. 在D点时v(正)<v(逆)
B. 反应2SO2(g)+O2(g)
2SO3(g)的ΔH<0
C. 若B、C点的平衡常数分别为KB、KC,则KB>KC
D. 恒温恒压下向平衡体系中通入氦气,平衡向左移动
难度: 中等查看答案及解析
-
将NO2装入带活塞的密闭容器中,当反应2NO2(g)
N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是( )
A. 升高温度,气体颜色加深,则此反应为吸热反应
B. 慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅
C. 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D. 恒温恒容时,充入惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅
难度: 中等查看答案及解析
-
在一固定体积的密闭容器中,进行下列反应:CO2(g)+H2(g)
CO(g)+H2O(g) ΔH=akJ·mol-1其化学平衡常数K和温度T的关系如右表所示:则下列有关叙述正确的是( )
T/℃
700
800
830
1 000
1 200
K
0.6
0.9
1.0
1.7
2.6
A. a<0
B. 可测量容器总压强变化来判定化学反应是否达到平衡
C. 温度为830 ℃时,若c(CO2)·c(H2)>c(CO)·c(H2O),此时v(正)>v(逆)
D. 温度不变,增大c(CO2),平衡右移,K增大
难度: 中等查看答案及解析