-
FeCl3、CuCl2的混合溶液中加入铁粉,充分应后仍有固体存在,下列判断不正确的是( )
A.加入KSCN溶液一定不变红色
B.溶液中一定含Fe2+
C.溶液中一定含Cu2+
D.剩余固体中一定含铜难度: 中等查看答案及解析
-
气体X可能是Cl2、HBr、CO2中的一种或几种,已知X通入AgNO3溶液时产生淡黄色沉淀,且沉淀不溶于稀硝酸,若将X通入澄清的石灰水中却不见沉淀产生,则对气体X的成分下列说法正确的是( )
A.一定含有HBr,一定不含CO2
B.一定含有HBr,可能含有CO2
C.一定不含CO2、Cl2
D.可能含有CO2、Cl2难度: 中等查看答案及解析
-
下列做法不正确的是( )
A.易燃试剂与强氧化性试剂分开放置并远离火源
B.用湿润的红色石蕊试纸检验氨气
C.在50 mL量筒中配制0.1000 mol•L-1碳酸钠溶液
D.金属钠着火时,用细沙覆盖灭火难度: 中等查看答案及解析
-
只用试管和胶头滴管就可以对下列各组中的两种溶液进行鉴别的是( )
①AlCl3溶液和NaOH溶液 ②Ca(HCO3)2溶液和NaOH溶液 ③Na[Al(OH)4]溶液和盐酸
④Al2(SO4)3溶液和氨水 ⑤Ag(NO3)2溶液和氨水.
A.①③⑤
B.①②③
C.②③④
D.③④⑤难度: 中等查看答案及解析
-
下列关于浓硫酸的叙述中,正确的是( )
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能够使铁、铝等金属形成氧化膜而钝化难度: 中等查看答案及解析
-
已知在硝酸溶液中加入铝粉不产生氢气.若在加入铝粉能放出氢气的无色溶液中,分别加入下列各组离子,可能大量共存的是( )
A.Ca2+、NO3ˉ、CO32-、Na+
B.Na+、Ba2+、Mg2+、HCO3-
C.NO3ˉ、Cu2+、K+、Clˉ
D.NO3ˉ、K+、AlO2ˉ、OHˉ难度: 中等查看答案及解析
-
只用一种试剂,能将NH4Cl、(NH4)2SO4、NaCl、NaSO4四种溶液区分开,这种试剂是( )
A.NaOH溶液
B.AgNO3溶液
C.BaCl2溶液
D.Ba(OH)2溶液难度: 中等查看答案及解析
-
钡和钠相似,也能形成含O22-离子的过氧化物,则下列叙述错误的是( )
A.过氧化钡的化学式是Ba2O2
B.1mol过氧化钠或过氧化钡跟足量水反应都生成0.5mol氧气
C.过氧化钡是离子化合物
D.过氧化钠或过氧化钡都是强氧化剂难度: 中等查看答案及解析
-
下列反应的离子方程式中错误的是( )
A.氯化铝溶液中加入过量的氨水Al3++3NH3•H2O=Al(OH)3↓+3NH4+
B.铁片放入过量的稀硝酸中3Fe+8H++2NO3-=3Fe2++2NO2↑+4H2O
C.将铝片放入过量NaOH溶液中2Al+2OH+2H2O=2AlO2-+3H2↑
D.偏铝酸钠与过量盐酸反应AlO2-+4H+=Al3++2H2O难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A.液溴易挥发,在存放液溴的试剂瓶中应加水封
B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C.某溶液中加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D.某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+难度: 中等查看答案及解析
-
观察是研究物质性质的一种基本方法.一同学将一小块金属钠露置于空气中,观察到下列现象:银白色
变灰暗
变白色
出现液滴
白色固体,下列说法正确的是( )
A.①发生了氧化还原反应
B.②变白色是因为生成了碳酸钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液
D.④只发生物理变化难度: 中等查看答案及解析
-
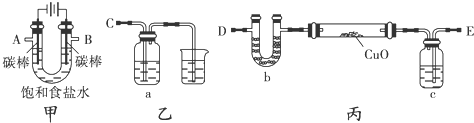
用下列实验装置进行相应实验,能达到实验目的是( )

A.用图(a)所示装置除去Cl2中含有的少量HCl
B.用图(b)所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图(c)所示装置制取少量纯净的CO2气体
D.用图(d)所示装置分离CCl4萃取碘水后已分层的有机层和水层难度: 中等查看答案及解析
-
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
选项 陈述Ⅰ 陈述Ⅱ A SO2有漂白性 SO2可使溴水褪色 B SiO2有导电性 SiO2可用于制备光导纤维 C 浓硫酸有强氧化性 浓硫酸可用于干燥H2和CO D Fe3+有氧化性 FeCl3溶液可用于回收废旧电路板中的铜
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下述实验设计能够达到目的是( )
选项 实验目的 实验设计 A 除去CO2中少量的SO2 将混合气体通过饱和Na2CO3溶液 B 除去Cu粉中混有的CuO 向混合物中滴加适量稀硝酸 C 检验溶液中是否含有Fe2+ 向溶液中滴入氯水后,再滴加KSCN溶液 D 证明H2CO3酸性比H2SiO3强 将CO2通入Na2SiO3溶液中
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量.下列表示氢氧化钠加入量(x)与溶液中沉淀的量(y)的关系示意图中正确的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
在下图的实验装置中,从实验开始过一段时间,对看到的现象叙述不正确的是( )
A.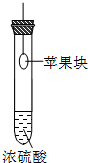
苹果块会干瘪
B.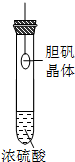
胆矾晶体表面有“白斑”
C.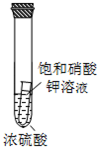
小试管内有晶体析出
D.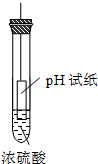
pH试纸变红难度: 中等查看答案及解析
-
将3.48gFe3O4完全溶解于100mL1mol/L硫酸中,然后加入K2Cr2O7溶液25mL,恰好使溶液中Fe2+全部转化为Fe3+,Cr2O72-全部还原为Cr3+,则K2Cr2O7溶液的物质的量浓度为( )
A.0.05mol/L
B.0.1mol/L
C.0.2mol/L
D.0.3mol/L难度: 中等查看答案及解析
-
氨气主要用于生产硝酸、尿素和其他化学肥料,还可用作医药和农药的原料.下列关于氨气的说法正确的是( )
A.氨气的水溶液能够导电,因此氨气为电解质
B.氨水稀释时溶液中各种微粒的浓度均减小
C.实验室可以用湿润的红色石蕊试纸检验氨气
D.工业合成氨时使用催化剂可以提高氨气的产率难度: 中等查看答案及解析
-
下列关于氮的说法正确的是( )
A.N2分子的结构较稳定,因而氮气不能支持任何物质燃烧
B.23 g NO2和N2O4混合气含有0.5NA个氮原子(NA表示阿伏加德罗常数)
C.NO可用向上排空气法或者排水法收集
D.浓硝酸保存在棕色瓶内是因为硝酸易挥发难度: 中等查看答案及解析
-
将50mL某未知浓度的AlCl3溶液分别加到60mL 1mol•L-1的NaOH溶液或60mL3mol•L-1的NaOH溶液中,均能得到1.56g Al(OH)3沉淀.则此AlCl3溶液的浓度可能是( )
A.1 mol•L-1
B.0.5 mol•L-1
C.0.6 mol•L-1
D.0.4 mol•L-1难度: 中等查看答案及解析