-
下列关于物质或离子检验的叙述正确的是
A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+
B.气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气
C.灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+
D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2
难度: 简单查看答案及解析
-
为了除去CuCl2酸性溶液中的Fe3+,可在加热条件下加入一种试剂,该试剂是
A.氢氧化钠 B.硫酸 C.氧化铜 D.氨水
难度: 中等查看答案及解析
-
在超市购买的食用调和油含有的主要成分属于
A.糖类 B.蛋白质 C.无机盐 D.油脂
难度: 简单查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.向稀HNO3中滴加Na2SO3溶液:SO32﹣+2H+=SO2↑+H2O
B.漂白粉溶液中通入足量二氧化硫气体:ClO﹣+SO2+H2O═HClO+HSO3-
C.NaHCO3溶液中加少量Ba(OH)2溶液:HCO3﹣+Ba2++OH﹣═BaCO3↓+H2O
D.向CuSO4溶液中加入Na2O2:2 Na2O2+2Cu2++2H2O═4Na++2Cu(OH
)2↓+O2↑
难度: 中等查看答案及解析
-
在标准状况下,1体积水溶解700体积NH3,所得溶液密度为0.9g·cm-3,这种氨水的物质的量浓度和溶质的质量分数分别为
A.18.4mol·L-1、34.7% B.20.4mol·L-1、38.5%
C.18.4mol·L-1、38.5% D.20.4mol·L-1、34.7%
难度: 中等查看答案及解析
-
亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,
其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。某温度下,部分含
氯组分含量随pH变化情况如图所示,下列说法不正确的是
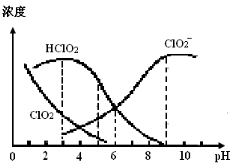
A.使用该漂白剂的适宜pH约为5.0
B.该温度下NaClO2溶液中:c(Na+)>c(ClO2-)>c(OH-)>c(H+)
C.该温度下HClO2的电离平衡常数的数值Ka≈1.0×10-6
D.不同pH的NaClO2溶液中存在下列关系:c(Na+)= c(ClO2-)+ c(HClO2)+ c(ClO2)
难度: 困难查看答案及解析
-
下列关于物质的检验说法正确的是
A.加入硝酸钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定有硫酸根离子
B.观察钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤后灼烧至无色,然后在用铂丝蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察
C.待检液加入NaOH溶液,有白色沉淀,则原溶液中有Al3+存在
D.某溶液中滴入KSCN溶液后呈红色,说明该溶液中有Fe2+
难度: 中等查看答案及解析
-
下列关于浓硝酸和浓硫酸的叙述,正确的是
A.常温下都能用铝制容器贮存
B.露置在
空气中,容器内酸液的质量都减轻
C.常温下都能与铜较快地反应
D.露置在空气中,容器内溶质的浓度都升高
难度: 中等查看答案及解析
-
在盛有水的电解槽中加入含等物质的量的Ag+,Pb2+,K+,SO42-,NO3-,Br-的物质,充分搅拌,然后用惰性电极电解,通电片刻后,氧化产物和还原产物的物质的量之比为
A.1:2 B.8:1 C. 1:1 D.80:108
难度: 中等查看答案及解析
-
下列常用的混合物分离或提纯操作中,需使用分液漏斗的是
A.过滤 B.蒸发 C.蒸馏 D.分液
难度: 中等查看答案及解析
-
下列实验现象与氧化还原反应有关的是
A.氨水中滴加石蕊试液显蓝色
B.NO2通入水中,气体由红棕色逐渐转变为无色
C.萃取时向碘水中滴加适量的稀盐酸,有透明的凝胶形成
D.向硅酸钠溶液中滴加适量的稀盐酸,有透明的凝胶形成
难度: 简单查看答案及解析
-
下列不是离子化合物的是
A.H2O B.CaI2 C.KOH D.NaNO3
难度: 简单查看答案及解析
-
氧化还原反应与四种基本反应类型的关系如下图所示,则下列化学反应中属于阴影3区域的是
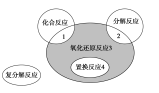
A.Cl2+2NaI=2NaCl+I2
B.NH4HCO3
NH3↑+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O=4Fe(OH)3
D.Fe2O3+3CO
2Fe+3CO2
难度: 简单查看答案及解析
-
下列描述的元素中,一定属于主族元素的有
A. 元素的原子最外层电子个数为2
B. 元素的原子最外层电子个数为6
C. 位于元素周期表中ⅡA族右边的元素
D. 阴离子RO4﹣中R元素
难度: 简单查看答案及解析
-
健康是人类永恒的主题。下列有关的叙述中正确的是
①蛋白质和糖类都是由碳、氢、氧元素组成的;
②铁是血红蛋白的成分,能帮助运输氧气,缺铁会患坏血病;
③淀粉、蛋白质、油脂都是有机高分子化合物;
④维生素有20多种,它们多数在人体内不能合成;
⑤蔬菜、水果和粗粮等都含有较多的纤维素。
A.①②③④ B.只有②④⑤ C.只有④⑤ D.只有②③⑤
难度: 简单查看答案及解析
-
外围电子构型为3d104s1的元素的原子在周期表中应位于
A. 第五周期ⅠB族 B. 第五周期ⅡB族
C. 第四周期ⅦB族 D. 第四周期ⅠB族
难度: 简单查看答案及解析
-
下列各组元素的性质递变情况错误的是
A. N、O、F原子最外层电子数依次增加
B. N、O、F原子半径依次增大
C. Na、Mg、Al元素最高正化合价依次升高
D. Li、Na、K的金属性依次增强
难度: 简单查看答案及解析
-
化学知识广泛应用于生产、生活中,下列叙述不正确的是
A.研发可降解高分子材料,减少“白色污染”
B.明矾和ClO2都能作为净水剂,其原理完全相同
C.海水淡化和工业生产及生活废水的再生利用,是解决缺水问题的有效途径
D.液氯罐泄漏时,可将其移入水塘中,并向水塘中加入生石灰
难度: 简单查看答案及解析
-
下列物质中不含非极性共价键的是:①Na2O2;②CCl4;③O2;④NH4Cl;⑤H2O2;⑥Ca(OH)2
A. ①②③④ B. ②④⑥ C. ④⑤⑥ D. ②③⑤
难度: 中等查看答案及解析
-
下列有关化学研究的正确说法是
A. 同时改变两个变量来研究反应速率的变化,能更快得出有关规律
B. 对于同一个化学反应,无论是正反应还是逆反应,其反应的焓变相同
C. 根据11~17号元素最高价氧化物对应水化物的酸碱性递变规律,推出同周期元素的金属性、非金属性递变规律
D. 从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属递增的规律
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A.氯化铝
溶液中加入过量氨水:A13++4NH3·H2O=4NH4++2H2O+A1O2-
B.氧化亚铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO十+3H2O
C.NaHCO3溶液和过量的Ba(OH)2溶液混合:2HCO3-+OH-+Ba2+=BaC
O3↓+2H2O+CO32-
D.用氨水吸收少量二氧化硫:2NH3·H2O+SO2=2NH4++SO32-+H2O
难度: 中等查看答案及解析
-
下列说法正确的是
①离子化合物一定含离子键,也可能含极性键
②共价化合物可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在化学键
⑥熔融状态下能导电的化合物一定是离子化合物
A.①③⑤ B.②④⑥ C.②③④ D.①③⑥
难度: 中等查看答案及解析
-
下列各组中的反应,属于同一反应类型的是
A.溴丙烷和氢氧化钠溶液反应制丙醇;丙烯与水反应制丙醇
B.甲苯硝化制对硝基甲苯;甲苯和高锰酸钾反应制苯甲酸
C.1-氯环己烷制环己烯;丙烯与溴反应制1,2-二溴丙烷
D.苯甲酸乙酯水解制苯甲酸和乙醇;乙酸和乙醇制乙酸乙酯
难度: 中等查看答案及解析
-
下列实验方法或操作能达到实验目的的是

难度: 中等查看答案及解析
-
下列装置能达到实验目的的是
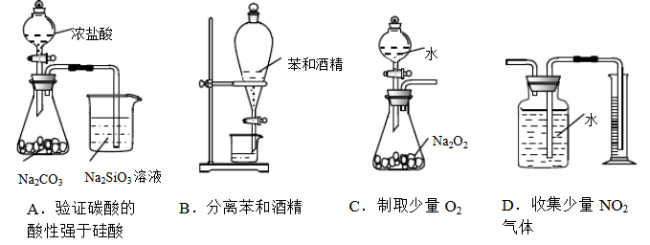
难度: 中等查看答案及解析
-
下列表示化学反应的离子方程式,其中正确的是:
A.NH4HSO3溶液与足量NaOH溶液共热:NH4++HSO3-+2OH-
NH3↑+SO32-+2H2O
B.向氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
C.大理石溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液Fe2++2H++H2O2═Fe3++2H2O
难度: 中等查看答案及解析
-
在铜的冶炼过程中有如下反应发生:5FeS2+1
4CuSO4+12H2O=7Cu2S+5FeSO4+12H2SO4,关于此反应,下列说明正确的是
A.Cu2S既是氧化产物,又是还原产物
B.5 mol FeS2发生反应,有10mol电子转移
C.产物中的SO42-有一部分是氧化产物
D.FeS2只作还原剂
难度: 中等查看答案及解析
-
某实验小组依据反应AsO43-+2H++2I-
AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响,测得输出电压与pH的关系如图。下列有关叙述错误的是
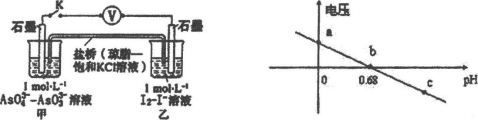
A.c点时,正极的电极反应为ASO43-+2H++2e-=AsO33-+H2O
B.b点时,反应处于化学平衡状态
C.a点时,盐桥中K+向左移动
D.pH>0.68时,氧化性I2>AsO43-
难度: 困难查看答案及解析
-
某化学科研小组研宄在其他条件不变时,改变某一条件对A2(g) +3B2 (g)
AB3 (g)化学平衡状态的影响,得到如右图所示的变化规律(图中T表示温度, n表示物质的景),根据如图可得出的判断结论正确的是
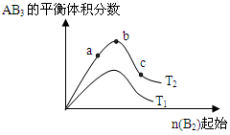
A.反应速率a>b>c
B.若T2>T1,则正反应一定是吸热反应
C.达到平衡时,AB3的物质的量大小为:b>c>a
D.达到平衡时A2的转化率大小为:b>a>c
难度: 困难查看答案及解析
-
下列溶液中离子浓度关系的表示正确的是
A.NaHCO3溶液中:c(H+)+c(Na+)==c(OH-)+c(CO32-)+c(HCO3-)
B.pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后的溶液中:c(OH-)>c(H+)
C.0.1mol/L的NH4Cl溶液中:c(Cl-)>c(H+)>c(NH4+)>c
(OH-)
D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:
2c(Na+)=c(CH3COOH)+c(CH3COO-)
难度: 中等查看答案及解析