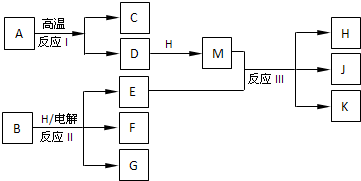
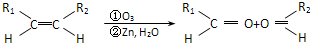
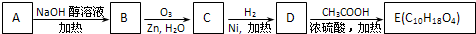-
吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧能加速人体衰老,被称为“生命杀手”,中国科学家尝试用Na2SeO3清除人体内的活性氧,则Na2SeO3的作用是( )
A.还原剂
B.氧化剂
C.既是氧化剂又是还原剂
D.以上均不是难度: 中等查看答案及解析
-
某溶液中除H+、OH-外,还含有大量的Mg2+、Fe3+、Cl-,且这三种离子的物质的量之比为1:1:6.下列有关该溶液的判断正确的是( )
A.向该溶液中加入稀NaOH溶液,立即产生白色沉淀
B.向该溶液中加入KI溶液后,原有的五种离子物质的量不变
C.若溶液中c(Cl-)=0.6 mol/L,则该溶液的pH为1
D.向该溶液中加入过量铁粉,只能发生置换反应难度: 中等查看答案及解析
-
下列有关物质分类或归类正确的是( )
①混合物:盐酸、氯水、水银 ②化合物:CaCl2、NaOH、HD
③电解质:胆矾、冰醋酸、氯化银 ④同素异形体:C60、金刚石、石墨
⑤放热反应:盐酸与氢氧化钠、碳与二氧化碳高温化合成一氧化碳、甲烷燃烧.
A.①③
B.②③
C.③④
D.④⑤难度: 中等查看答案及解析
-
以色列科学家发现准晶体独享2011年诺贝尔化学奖.已知的准晶体都是金属互化物.有关准晶体的组成与结构的规律仍在研究之中.人们发现组成为铝-铜-铁-铬的准晶体具有低摩擦系数、高硬度、低表面能以及低传热性,正被开发为炒菜锅的镀层.Al65Cu23Fe12十分耐磨,被开发为高温电弧喷嘴的镀层.下列说法正确的是( )
A.离子化合物形成的晶体一定有金属元素
B.共价化合物中一定没有非极性键
C.合金是纯净物
D.准晶体可开发成为新型材料难度: 中等查看答案及解析
-
某同学在实验室进行了如图所示的实验,下列说法中错误的是( )
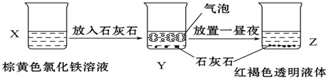
A.利用过滤的方法,可将Z中固体与液体分离
B.X、Z烧杯中分散质相同
C.Y中反应的离子方程式为:3CaCO3+2Fe3++3H2O═2Fe(OH)3+3CO2↑+3Ca2+
D.Z中分散系能产生丁达尔效应难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.在1 L 0.2 mol•L-1的Na2CO3溶液中含有CO32-的数目为0.2NA
B.0.1molFe参加氧化还原反应,转移的电子数目一定是0.3 NA
C.标准状况下22.4 L CH4和C2H4的混合气体所含氢原子数为4NA
D.15.6 g Na2O2 与过量CO2反应时,转移的电子数为0.4NA难度: 中等查看答案及解析
-
北京时间2011年9月29日21时16分,我国在酒泉卫星发射中心载人航天发射场,用“长征二号F”T1运载火箭成功发射全新研制的首个目标飞行器“天宫一号”. 从如图的发射现场可以看到:从火箭的下部喷射出大量的红棕色的气体,关于这种红棕色气体的认识正确的是( )

A.红棕色气体是溴蒸气,可以喷洒NaOH溶液吸收
B.红棕色气体是NO2,可以喷洒稀碱溶液吸收
C.红棕色气体是N2O4,可以喷洒稀碱溶液吸收
D.红棕色气体是NO,可以喷洒NaOH溶液吸收难度: 中等查看答案及解析
-
下列叙述正确的是( )
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤多电子原子中,在离核较近的区域内运动的电子能量较高
⑥已知2H2(g)+O2(g)=2H2O(l)△H=-571kJ•mol-1则氢气的燃烧热为285.5kJ•mol-1
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N.
A.只有②④⑥
B.只有①⑤⑥
C.只有②③④
D.只有③⑤⑦难度: 中等查看答案及解析
-
某课外实验小组设计的如图实验合理的是( )
A.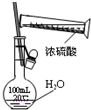
配制一定浓度硫酸溶液
B.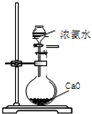
制备少量氨气
C.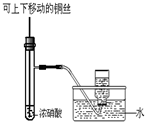
制备并收集少量NO2气体
D.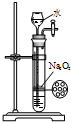
制备少量氧气难度: 中等查看答案及解析
-
在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg•cm-3,溶质的质量分数为ω,溶质的物质的量浓度为c mol/L.下列叙述中正确的是( )
①ω=
②c=
③上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
④上述溶液中再加入1.5VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
A.①④
B.②③
C.①③
D.②④难度: 中等查看答案及解析
-
将1mol A(g)和2mol B(g)置于2L某密闭容器中,在一定温度下发生反应:A(g)+B(g)⇌C(g)+D(g),并达到平衡.C的体积分数随时间变化如下图I中曲线b所示,反应过程中的能量变化如图Ⅱ所示,下列说法不正确的是( )
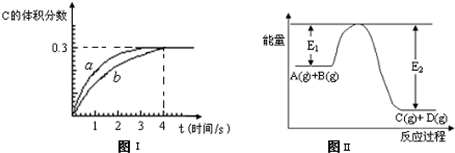
A.反应在第4秒钟达到化学平衡状态,0~4秒内,以A表示的化学反应速率是0.225mol•L-1•s-1
B.该温度下,反应的平衡常数数值约为7.36
C.恒温条件下,缩小反应容器体积可以使反应 的过程按图I中a曲线进行
D.在上述反应体系中加入催化剂,化学反应速率增大,E1和E2均减小难度: 中等查看答案及解析
-
甲、乙、丙、丁4种物质分别含2种或3种元素,它们的分子中各含18个电子,甲是气态氢化物,在水中分步电离出两种阴离子,下列推断合理的是( )
A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应
B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键
C.丁和甲中氢元素质量比相同,则丁中一定含有氧元素
D.丙中含有第2周期ⅣA族的元素,则丙一定是甲烷的同系物难度: 中等查看答案及解析
-
有X、Y、Z三种短周期主族元素,它们在周期表中的位置关系如图,下列有关说法中一定正确的是( )
A.原子半径大小为:Y>Z>X
B.Y与Z形成的化合物是离子化合物
C.若Y为金属元素,则X也为金属元素
D.若Z的最高价氧化物对应的水化物是强酸,则Y元素的最高价氧化物具有两性难度: 中等查看答案及解析
-
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2遇水易水解,并产生能使品红溶液褪色的气体.下列说法错误的是( )

A.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
B.S2Cl2分子中含有极性键和非极性键
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2的电子式为难度: 中等查看答案及解析
-
已知A、B为单质,C为化合物,它们之间存在如下转化关系则下列说法中正确的是( )
A+BC
A+B
①若C溶于水后得到强碱溶液,则A可能是Na
②若向C溶液中逐滴加入NaOH溶液的过程中,溶液中出现白色沉淀并逐渐消失,则A可能Al
③若C的溶液遇NaHCO3固体,放出CO2气体,则A可能是H2
④若C的溶液中滴加KSCN溶液显红色,则B可能为Fe
⑤若C的溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu.
A.①②③
B.②④
C.③⑤
D.①④⑤难度: 中等查看答案及解析