-
化学来源于生活,也服务于生活,下列有关生活中的化学叙述正确的是
A.冰箱中使用的含氟制冷剂泄露后,会增加空气中的PM2.5
B.浓硫酸具有强腐蚀性,可用浓硫酸刻蚀石英制艺术品
C.施肥时,农家肥草木灰(有效成分K2CO3)不能与氮肥NH4Cl混合使用
D.氯气和活性炭均可作为漂白剂,若同时使用,漂白效果会明显加强
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1NA
B.10g46%的乙醇水溶液中所含氢原子数目为1.2NA
C.高温下,0.2mol的铁与足量的水蒸气反应,生成氢气的分子数目为0.3NA
D.25℃时,100mlpH=13的Ba(OH)2溶液中OH-的数目为0.02NA
难度: 中等查看答案及解析
-
X、Y、Z、R、W是原子序数依次增大的五种短周期元素。Y和R同主族,可组成共价化合物RY2,Y和Z最外层电子数之和与W的最外层电子数相同。25℃时,0.1mol/LX和W形成化合物的水溶液pH=1。下列说法正确的是
A.Z与Y、Z与W形成的化合物的化学键完全相同
B.Y、Z、W三种元素组成的化合物的水溶液可能显碱性
C.简单离子的半径:Z﹥R﹥W﹥Y
D.因非金属Y﹥R,所以X与Y组成化合物的沸点低于X与R组成的化合物
难度: 中等查看答案及解析
-
根据下列实验或实验操作和现象,所得结论正确的是
实验或实验操作
现象
实验结论
A
用大理石和盐酸反应制取CO2 气体,立即通入一定浓度的Na2SiO3 溶液中
出现白色沉淀
H2CO3的酸性比H2SiO3的酸性强
B
向某溶液先滴加硝酸酸化,再滴加BaCl2溶液
有白色沉淀生成
原溶液中含有SO42-、SO32-、HSO3-中的一种或几种
C
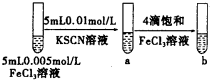
试管b比试管a中溶液的红色深
增大反应物浓度,平衡向正反应方向移动
D
左边棉球变为橙色,右边棉球变为蓝色
氧化性:Cl2>Br2>I2
难度: 困难查看答案及解析
-
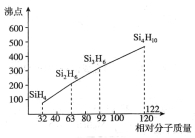
某烷烃相对分子质量为86,如果分子中含有3个—CH3、2个—CH2—和1个
,则该结构的烃的一氯取代物最多可能有( )种(不考虑立体异构)
A.9 B.6 B.5 D.4
难度: 困难查看答案及解析
-
在下列给定条件的溶液中,一定能大量共存的粒子组是
A.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
B.常温下,
=0.001 mol·L-1的溶液:Na+、K+、SiO32-、NO3-
C.常温下由水电离出来的c(H+)=1.0×10 -13mol·L-1溶液中:AlO2-、K+、SO42-、Br-
D.与铝反应产生大量氢气的溶液:Na+、K+、NH4+、NO3-
难度: 困难查看答案及解析
-
常温下,下列说法不正确的是
A.等体积、等物质的量浓度的NaCl(aq) 离子总数大于NaClO(aq)中离子总数
B.pH=3的硫酸溶液中水的电离程度等于pH=11的氨水溶液中水的电离程度
C.0.1 mol/L的NaHA溶液pH=5,则溶液:c(HA-)>c(H+)>c(A2-)>c(H2A)
D.向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
难度: 困难查看答案及解析
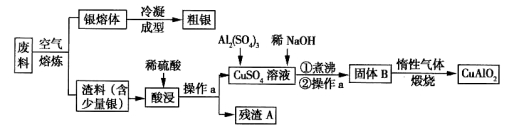


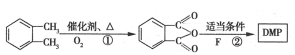
 (代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97。工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97。工业上生产DMP的流程如图所示: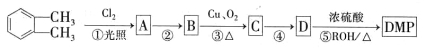
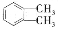 的名称
的名称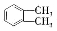 制备DMP的另一种途径:
制备DMP的另一种途径: