-
化学与科学、技术、社会、环境密切相关,下列叙述正确的是
A. 石油裂解的主要目的提高汽油等轻质油的产量与质量
B. 在食品包装时放入盛有铁粉的透气小袋可防止食品氧化变质
C. 汽车尾气催化转化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,有利于提高该反应的平衡转化率
D. 近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,16g的甲醇所含的质子数等于10NA
B. 7.8g Na2S和Na2O2的混合物中所含离子数为0.3NA
C. 常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA
D. 电解精炼铜时,阳极质量每减少32g,电路中就转移NA个电子
难度: 中等查看答案及解析
-
X、Y、Z、W为原子序数依次增大的短周期元素,其形成的小分子化合物Y2X2、Z2X4、X2W2中,分子内各原子最外层电子都满足稳定结构.下列说法正确的是
A. X、Y、Z、W四种元素可形成具有两性的物质
B. 在Y2X2、Z2X4、X2W2的一个分子中,所含的共用电子对数相等
C. X、Y、Z、W的原子半径的大小关系为:W>Y>Z>X
D. 与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键
难度: 中等查看答案及解析
-
25℃时,下列有关电解质溶液的说法正确的是( )
A. 将Na2CO3溶液用水稀释后,pH变大,Kw不变
B. 向有AgCl固体的饱和溶液中加少许水,c(Ag+)和Ksp(AgCl)都不变
C. pH=4.75浓度均为0.1mol/L的CH3COOH、CH3COONa的混合溶液中:c(CH3COO-)+c(OH-)
<c(H+)+c(CH3COOH)
D. 分别用pH=2和pH=3 的 CH3COOH溶液中和等物质的量的NaOH,消耗CH3COOH溶液的体积分别为Va和Vb,则10Va=Vb
难度: 困难查看答案及解析
-
乙酸橙花酯是一种食用香料,其结构简式如右图所示,关于该有机物的下列叙述中不正确的是
A. 分子式为C12H20O2
B. 能使酸性KMnO4溶液褪色
C. 1mol该有机物水解时只能消耗1molNaOH
D. 能发生加成反应,但不能发生取代反应
难度: 中等查看答案及解析
-
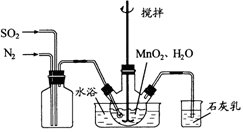
下列实验操作及现象能够达到对应实验目的的是
选项
实验操作及现象
实验目的
A
将SO2通入到Ba(NO3)2溶液中,产生白色沉淀
证明SO2与可溶性钡盐溶液反应产生沉淀
B
常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有少量气泡产生
证明常温下,Ksp(BaCO3)>Ksp(BaSO4)
C
常温下,测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH
证明相同条件下,在水中HCl电离程度大于CH3COOH
D
将浓硫酸与碳混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊
检验气体产物中CO2的存在
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度。它无电时也无需充电,用作燃料电池时,可更换正极的水性电解液和卡盒以及负极的金属锂就可以连续使用,分离出的氢氧化锂可采用电解其熔融物法回收锂而循环使用。其工作示意图见图,下列说法不正确的是

A. 放电时,负极的电极反应式为Li-e-=Li+
B. 熔融的氢氧化锂用惰性电极电解再生时,金属锂在阴极得到
C. 有机电解液可以是乙醇等无水有机物
D. 放电时,正极的电极反应式为:2H2O+O2+4e-=4OH-
难度: 中等查看答案及解析