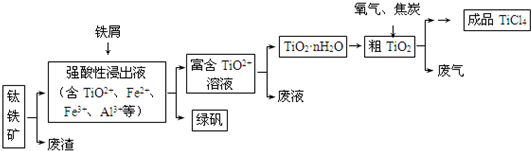
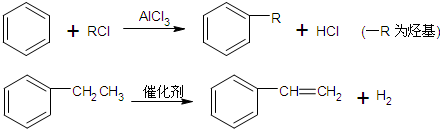
-
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源.该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电.关于该电池的下列说法不正确的是( )
A.水既是氧化剂又是溶剂
B.放电时正极上有氢气生成
C.放电时OH-向正极移动
D.总反应为:2Li+2H2O=2LiOH+H2↑难度: 中等查看答案及解析
-
依据元素周期表及元素周期律,下列推断正确的是( )
A.H3BO3的酸性比H2CO3的强
B.Mg(OH)2的碱性比Be(OH)2的强
C.HCl、HBr、HI的热稳定性依次增强
D.若M+和R2-的核外电子层结构相同,则原子序数:R>M难度: 中等查看答案及解析
-
下列关于有机化合物的认识错误的是( )
A.油脂在空气中完全燃烧转化为水和二氧化碳
B.蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
C.在水溶液里,乙酸分子中的-CH3可以电离出H+
D.在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应难度: 中等查看答案及解析
-
下列关于化学与生产、生活的认识不正确的是( )
A.CO2、CH4、N2等均是造成温室效应的气体
B.使用清洁能源是防止酸雨发生的重要措施之一
C.节能减排符合低碳经济的要求
D.合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺难度: 中等查看答案及解析
-
下表各选项中,不能利用置换反应通过Y得到W的一组化合物是( )
① ② ③ ④ Y CO2 Fe2O3 C2H5OH FeCl3 W MgO Al2O3 C2H5ONa CuCl2
A.①
B.②
C.③
D.④难度: 中等查看答案及解析
-
常温下0.1mol•L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是( )
A.将溶液稀释到原体积的10倍
B.加入适量的醋酸钠固体
C.加入等体积0.2 mol•L-1盐酸
D.提高溶液的温度难度: 中等查看答案及解析
-
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)⇌Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
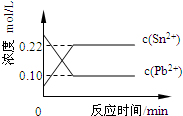
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0
D.25℃时,该反应的平衡常数K=2.2难度: 中等查看答案及解析