-
下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2O⇌HCOO-+H3O+
B.CO2+H2O⇌HCO3-+H+
C.CO32-+H2O⇌HCO3-+OH-
D.HS-+H2O⇌S2-+H3O+难度: 中等查看答案及解析
-
等物质的量浓度的下列溶液中,NH4+的浓度最大的是( )
A.NH4Cl
B.NH4HCO3
C.NH4HSO4
D.NH4NO3难度: 中等查看答案及解析
-
电子表所用的纽扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应式是:Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-.总反应式为:Ag2O+Zn=2Ag+ZnO,下列说法正确的是( )
A.Zn为正极,Ag2O为负极
B.Zn为负极,Ag2O为正极
C.原电池工作时,正极区溶液PH值增大
D.原电池工作时,负极区溶液PH值增大难度: 中等查看答案及解析
-
溶液中由水电离产生的c(OH-)=1×10-14mol•L-1,满足此条件的溶液中一定能大量共存的离子组是( )
A.Al3+ Na+ NO3- Cl-
B.K+ Ba2+ Cl- NO3-
C.K+Na+ Cl-CO32-
D.K+ NH4+ SO42- NO3-难度: 中等查看答案及解析
-
能说明醋酸是弱电解质的是( )
①用浓硫酸和醋酸钠固体共热可制得醋酸;②醋酸钠溶液呈碱性;③可以用食醋清除热水瓶内的水垢;④pH=2的醋酸溶液稀释1000倍后pH小于5.
A.①③④
B.①②
C.②④
D.②难度: 中等查看答案及解析
-
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS).下列分析一定正确的是( )
A.KSP(PbS)<Kap(CuS)
B.原生铜的硫化物具有还原性,而铜蓝没有还原性
C.CuSO4与ZnS反应的离子方程式是Cu2++S2-═CuS↓
D.整个过程涉及的反应类型有氧化还原反应和复分解反应难度: 中等查看答案及解析
-
实验室用足量镁粉与一定量的某浓度的盐酸反应来制得氢气.由于反应速率太快,不易操作.为减慢反应速率,同时又不影响生成H2的总量,可向盐酸中加入的物质是( )
A.K2SO4固体
B.NaOH溶液
C.(NH4)2SO4粉末
D.CH3COONa固体难度: 中等查看答案及解析
-
相同温度、相同物质的量浓度的四种溶液:①CH3COONa;②NaHSO4;③;NH4Cl;④NaCl⑤NaHCO3⑥NaCN按pH由大到小的顺序排列,正确的是( )
A.⑤>⑥>①>③>④>②
B.⑥>⑤>①>④>③>②
C.②>③>④>①>⑤>⑥
D.⑥>①>⑤>③>④>②难度: 中等查看答案及解析
-
下列物质的水溶液在蒸干、灼烧后,得到的固体为原先溶质的是( )
A.NaAlO2
B.AlCl3
C.Na2SO3
D.(NH4)2CO3难度: 中等查看答案及解析
-
下列说法正确的是( )
A.pH=7的溶液一定是中性溶液
B.能自发进行的化学反应,不一定是△H<0、△S>0
C.白色污染、绿色食品中的“白”“绿”均指相关物质的颜色
D.Ksp不仅与难溶电解质的性质和温度有关,而且与溶液中的离子浓度有关难度: 中等查看答案及解析
-
有一支50mL的酸式滴定管,其中盛有溶液,液面恰好在30mL处,把管中的溶液全部放出,承接在量筒中溶液的体积是( )
A.等于30mL
B.等于20mL
C.大于20mL
D.大于30mL难度: 中等查看答案及解析
-
下列说法正确的是( )
A.相同温度时,1mol/L氨水与0.5mol/L氨水中,C(OH-)之比是2:1
B.1mol/L NH4Cl溶液中 c (NH4+)=c (Cl-)
C.0.1mol/LCH3COONa溶液中加少量CH3COOH溶液,使溶液呈中性,此时混合液中c (Na+)=c (CH3COO-)
D.硫化钠溶液中,c (Na+)=2 c (S2-)难度: 中等查看答案及解析
-
1g炭与适量水蒸气反应生成一氧化碳和氢气,需吸收10.94kJ的热量,相应的热化学方程式为( )
A.C+H2O=CO+H2△H=+10.9 kJ/mol
B.C(s)+H2O(g)=CO(g)+H2(g)△H=+10.94 kJ/mol
C.C(s)+H2O(g)=CO(g)+H2(g)△H=+131.28 kJ/mol
D.C(s)+
H2O(g)=
CO(g)+
H2(g )△H=+65.64 kJ/mol
难度: 中等查看答案及解析
-
实验测得常温下0.1mol/L某一元酸(HA)溶液的pH值等于1,0.1mol/L某一元碱(BOH)溶液里
=10-12.将此两种溶液等体积混合后,所得溶液呈的各离子的浓度由大到小排列的顺序是( )
A.c (B+)>c (A-)>c (OH-)>c (H+)
B.c (A-)>c (B+)>c (H+)>c (OH-)
C.c (B+)=c (A-)>c (H+)=c (OH-)
D.c (B+)>c (A-)>c (H+)>c (OH-)难度: 中等查看答案及解析
-
若将反应:Zn+H2SO4=ZnSO4+H2↑设计成原电池(装置如图),则下列说法正确的是( )
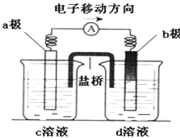
A.d溶液是稀硫酸
B.c溶液颜色变蓝
C.b极发生氧化反应
D.a极是铜棒难度: 中等查看答案及解析
-
在密闭容器中充入0.5mol N2和1.5mol H2发生反应:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1,充分反应后放出的热量为( )
A.等于92.4kJ
B.等于46.2kJ
C.大于46.2kJ
D.小于46.2kJ难度: 中等查看答案及解析
-
把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池.若A、B相连时,A为负极;C、D相连,D上有气泡逸出;A、C相连时A极减轻;B、D相连,B为正极.则四种金属的活泼性顺序由大到小排列为( )
A.A>C>D>B
B.A>C>B>D
C.B>D>C>A
D.A>B>C>D难度: 中等查看答案及解析
-
用石墨做电极电解CuSO4溶液.通电一段时间后,欲使用电解液恢复到起始状态,应向溶液中加入适量的( )
A.CuSO4
B.H2O
C.CuO
D.CuSO4•5H2O难度: 中等查看答案及解析
-
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.下列说法不正确的是( )
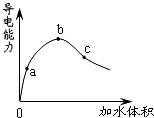
A.在0点时,醋酸不导电
B.a、b、c三点,a点时醋酸溶液中H+浓度最小
C.b点时,醋酸电离程度最大
D.可通过微热的方法使c点溶液中c(CH3COO-)增大难度: 中等查看答案及解析
-
在密闭容器中发生如下反应:mA(g)+nB(g)⇌pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是( )
A.m+n<p
B.平衡向逆反应方向移动
C.A的转化率降低
D.C的体积分数增加难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3醋酸溶液等体积混合,滴入石蕊试液呈红色
D.向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中增大
难度: 中等查看答案及解析
-
下列方程式的书写或描述正确的是( )
A.用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO32-═CaCO3↓+SO42-
B.热化学方程式C2H2(g)+O2(g)═2CO2(g)+H2O(g);△H=-1256kJ/mol,表示乙炔的燃烧热为1256kJ/mol
C.铂电极电解MgCl2饱和溶液:MgCl2Mg+Cl2↑
D.H+(aq)+OH(aq)═H2O(1);△H=-57.3 kJ/mol,表示含1 mol NaOH的氢氧化钠溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量难度: 中等查看答案及解析
-
某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:H2A⇌H++HA-;HA-⇌H++A2-,下列四种溶液中c(H2A)最大的是( )
A.0.01 mol•L-1的H2A溶液
B.0.01 mol•L-1的NaHA溶液
C.0.02 mol•L-1的盐酸与0.04 mol•L-1的NaHA溶液等体积混合液
D.0.02 mol•L-1的NaOH与0.02 mol•L-1的NaHA溶液等体积混合液难度: 中等查看答案及解析
-
用石墨电极电解100mL H2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集到2.24L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为( )
A.1mol•L-1
B.2 mol•L-1
C.3 mol•L-1
D.4 mol•L-1难度: 中等查看答案及解析
-
在25ml 0.1mol•L-1NaOH溶液中逐滴加入0.2mol•L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是( )
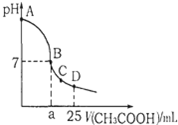
A.在A、B间任一点(不含A、B点),溶液中可能有c (Na+)>c (CH3COO-)>c (OH-)>c (H+)
B.在B点,a>12.5,且有c (Na+)=c (CH3COO-)=c (OH-)=c (H+)
C.在C点,c (CH3COO-)>c (Na+)>c (OH-)>c (H+)
D.在D点,c (CH3COO-)+c (CH3COOH)=c (Na+)难度: 中等查看答案及解析
-
右图是一种航天器能量储存系统原理示意图.
下列说法正确的是( )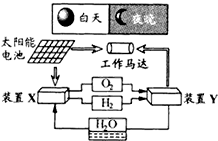
A.该系统中只存在3种形式的能量转化
B.装置Y中负极的电极反应式为:O2+2H2O+4e-=4OH-
C.装置X能实现燃料电池的燃料和氧化剂再生
D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化难度: 中等查看答案及解析