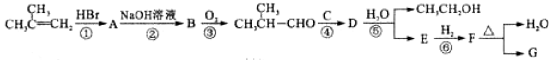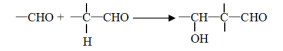-
下列说法正确的是()
A.16O和18O的原子结构示意图均为
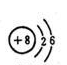
B.在Na2O2和CaCl2中均含有共价键和离子键
C.结构示意图为
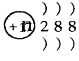 的阴离子都不能破坏水的电离平衡
的阴离子都不能破坏水的电离平衡D.电子式
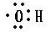 可以表示羟基,也可以表示氢氧根离子
可以表示羟基,也可以表示氢氧根离子难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.lmolFeI2与足量氯气反应时转移的电子数为2NA
B.标准状况下,22.4LSO3含有NA个SO3分子
C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA
D.56g铁片投入足量浓H2SO4中生成NA个SO2分子
难度: 中等查看答案及解析
-
类推的思维方法可解决不少化学问题,但类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中,你认为正确的是( )
A.沸点HBr>HCl,则同族元素氢化物沸点HCl>HF
B.Fe3O4可表示为FeO•Fe2O3,则Pb3O4可表示为PbO•Pb2O3
C.CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应也只生成Na2SO3和O2
D.因为N元素的非金属性比P元素强,所以HNO3的酸性强于H3PO4
难度: 中等查看答案及解析
-
反应A(g)+3B(g) = 2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
A.v(A)=0.15 mol·L-1·min-1 B.v(B)=0.01 mol·L-1·s-1
C.v(C)=0.40 mol·L-1·min-1 D.v(D)=0.45 mol·L-1·min-1
难度: 简单查看答案及解析
-
下列各组离子能大量共存的是( )
①“84”消毒液的水溶液中:Fe2+、Cl-、Ca2+、Na+ ②加入KSCN显红色的溶液:K+、NH4+、Cl-、S2- ③能够与金属Cu常温下反应放出气体的溶液:Fe3+、Al3+、SO42-、K+ ④pH=2的溶液中:NH4+、Na+、Cl-、Cu2+⑤无色溶液中:K+、CH3COO-、HCO3-、MnO4-
A. ②③ B. ①③ C. ①⑤ D. ③④
难度: 困难查看答案及解析
-
为探究Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是( )

A.图1实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图1所示的实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C.用图2装置比较反应速率,可测定在相同状况下反应产生的气体体积及反应时间
D.为检查图2装置的气密性,可关闭分液漏斗A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否复原
难度: 困难查看答案及解析
-
能正确表示下列反应的离子方程式是( )
A.AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O
AlO2- +4NH4+ +2H2O
B.碳酸氢铵溶液中加入足量氢氧化钡溶液: NH4++HCO3﹣+2OH-
CO32﹣+ NH3·H2O + H2O
C.Cu溶液于稀HNO3:3Cu+8H++2NO3- =3Cu2++2NO↑+4H2O
D.用铜电极电解饱和食盐水:2Cl-+2H2O
Cl2↑+H2↑+2OH-
难度: 中等查看答案及解析
-
在催化剂、400℃时可实现氯的循环利用,如图是其能量关系图,下列分析正确的是( )
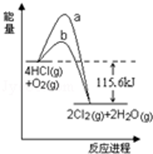
A.曲线a是使用了催化剂的能量变化曲线
B.反应物的总键能高于生成物的总键能
C.反应的热化学方程式为:4HCl(g)+O2(g)
 2Cl2+2H2O(g)△H=﹣115.6 kJ•mol﹣1
2Cl2+2H2O(g)△H=﹣115.6 kJ•mol﹣1D.若反应生成2mol液态水,放出的热量高于115.6 kJ
难度: 中等查看答案及解析
-
少量铁粉与100 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加NaOH固体 ③滴入几滴浓硫酸 ④加CH3COONa固体 ⑤加NaCl溶液⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
A.①⑥⑦ B. ③⑤⑧ C. ③⑦⑧ D. ⑤⑦⑧
难度: 中等查看答案及解析
-
将含有0.4 mol NaCl和0.5 mol Cu(NO3)2的水溶液用惰性电极电解一段时间后,在一个电极上得到0.3 mol Cu,则在另一个电极上逸出的气体(标准状况下)的体积是( )
A.4.48 L B.5.6L C.6.72L D.11.2L
难度: 中等查看答案及解析
-
下列事实不能用平衡移动原理解释的是( )

难度: 中等查看答案及解析
-
有A、B、C、D、E五块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电子由 D→导线→C;③B、C相连后,同时浸入稀H2SO4溶液中,B极产生大量气泡;④A、D相连后,同时浸入稀H2SO4溶液中,A极发生氧化反应;⑤用惰性电极电解含B离子和E离子的溶液,E先析出。据此,判断五种金属的活动性顺序是 ( )
A.A>B>D>C>E B.A>C>D>E>B C.C>A>B>D>E D.A>D>C>B>E
难度: 中等查看答案及解析
-
某小组用下图装置进行实验,下列说法正确的是( )

A.盐桥中的电解质可以用KCl
B.闭合K,外电路电流方向为Fe电极→石墨电极
C.闭合K,石墨电极上只生成铜
D.导线中流过0.15 mol e﹣时,加入5.55gCu2(OH)2CO3,CuSO4溶液可恢复原组成
难度: 困难查看答案及解析
-
下列实验装置(固定装置略去)和操作正确的是 ( )

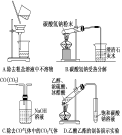
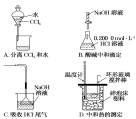
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.已知P(红磷,s)=P(白磷,s)△H>0,则白磷比红磷稳定
B.测定相同物质的量浓度的Na2CO3、Na2SiO3的溶液pH,发现后者的更高, 说明碳的非金属性强于硅。
C.温度和压强一定时,对于可逆反应:2NO2(g)
N2O4(g),混合气体的密度不再改变,则反应达到平衡状态
D.将NaAlO2溶液与NaHCO3溶液混合后生成白色沉淀,是两种溶液水解相互促进的结果
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是( )
A.含有Y元素的可溶性盐溶于水一般都可以破坏水的电离平衡
B.Z的最高价氧化物能与水反应生成相应的酸
C.X、Y、Z原子半径由小到大的顺序是Y>Z>X
D.常温下,0.1 mol·L-1 W的气态氢化物的水溶液的pH>1
难度: 中等查看答案及解析
-
下列四个图象所反映的内容与相应反应符合的是(a、b、c、d均大于0)( )
A.
 4NH3(g)+5O2(g)
4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=﹣a kJ•mol﹣1
B.
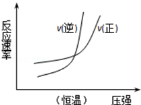 N2(g)+3H2(g)
N2(g)+3H2(g)2NH3(g)△H=﹣b kJ•mol﹣1
C.
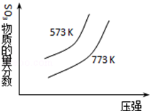 2SO3(g)
2SO3(g)2SO2(g)+O2(g)△H=+c kJ•mol﹣1
D.
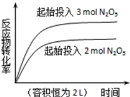 2N2O5(g)
2N2O5(g)4NO2(g)+O2(g)△H=+d kJ•mol﹣1
难度: 中等查看答案及解析
-
向FeI2,FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。已知:2Fe2++Br2===2Fe3++2Br-,2Fe3++2I-===2Fe2++I2。则下列有关说法中,不正确的是( )。
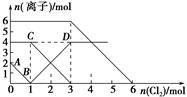
A.线段BD表示Fe3+物质的量的变化
B.原混合溶液中FeI2的物质的量为1mol
C.当通入2 mol Cl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
D.原溶液中:n(Fe2+)∶n(I-)∶n(Br-)=2∶3∶1
难度: 困难查看答案及解析
-
人工肾脏可用电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图,下列有关说法正确的是( )
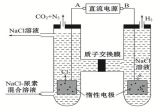
A.B为电源的正极
B.电解结束后,阴极室溶液的pH与电解前相比将升高
C.电子移动的方向是B→右侧惰性电极→质子交换膜→左侧惰性电极→A
D.阳极室中发生的反应依次为2Cl﹣﹣2e﹣=Cl2↑、CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl
难度: 中等查看答案及解析
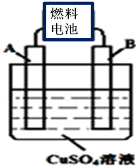
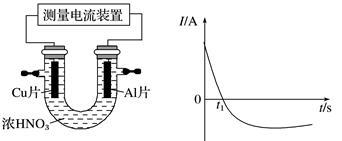

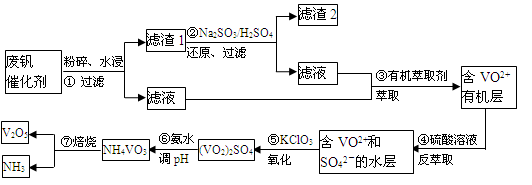
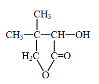 。
。