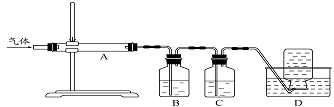
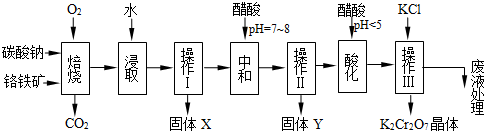
-
下列措施有利于节能减排、改善环境质量的有
① 发展核电,以减少火力发电带来的二氧化硫和二氧化碳排放问题
② 积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料
③ 加速建设地铁、轻轨等轨道交通,减少汽车尾气排放
④ 发展低碳经济、循环经济,推广可利用太阳能、风能的城市照明系统
⑤ 使用生物酶降解生活废水中的有机物,使用填埋法处理未经分类的生活垃圾
A.①②③④ B. ①②⑤ C. ①②④⑤ D. ③④⑤
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 0.2mol铁粉与足量水蒸气反应生成的H2分子数为0.3NA
B. 常温常压下,0.1mol Na2O2与CO2完全反应转移电子数为0.1NA
C. 50mL18.4mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
D. 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA
难度: 中等查看答案及解析
-
下列物质转化在给定条件下能实现的是
①

②
③

④

⑤

A. ①③⑤ B. ②③④ C. ②④⑤ D. ①④⑤
难度: 中等查看答案及解析
-
下列相关反应的离子方程式书写错误的是
A.在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:3ClO—+4OH—+2Fe(OH)3=3Cl—+5H2O+2FeO42—
B.少量SO2通入苯酚钠溶液中:2C6H5O—+SO2+H2O=2C6H5OH+SO32—
C.0.01mol·L-1NH4Al(SO4)2溶液与0.02mol·L-1Ba(OH)2溶液等体积混合:
NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O
D.少量SO2通入NaClO溶液中:SO2 + ClO—+ OH—= SO42— + Cl— + H+
难度: 困难查看答案及解析
-
一定温度下,将1molA和1molB气体充入2L恒容密闭容器,发生反应A(g)+ B(g)
xC(g)+D(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示。下列说法正确的是

A.反应方程式中的x=1
B.t2时刻改变的条件是使用催化剂
C.t3时刻改变的条件是移去少量物质D
D.t1~t3间该反应的平衡常数均为4
难度: 中等查看答案及解析
-
下述实验能达到预期目的的是
实验内容 实验目的
A 向1mL0.2mol/LNaOH溶液中滴入2滴0.1mol/LMgCl2 溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 证明在相同条件下,溶解度Mg(OH)2>Fe(OH)3
B 向混有BaCO3沉淀的NaOH溶液中滴入已知浓度的盐酸(用酚酞作指示剂) 滴定其中NaOH含量
C 两种一元碱溶液X和Y(X的pH比Y大l),分别加水稀释l00倍后,pH相等 证明稀释前c(X)=10c(Y)
D 测定等物质的量浓度的HF与HCl溶液的pH,后者较小 证明非金属性Cl>F
难度: 中等查看答案及解析
-
常温下,在某200 mL的稀硫酸和稀硝酸的混合溶液中逐量地加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。(设硝酸只被还原为NO气体, Fe的相对原子质量为56)。下列有关分析错误的是

A、原混合酸中NO3-的物质的量为0.2 mol
B、原混合酸中H2SO4物质的量浓度为2mol/L
C、OA段与BC段反应中电子转移的物质的量之比为2:1
D、取20mL原混合酸加水稀释至1L后溶液的pH=1
难度: 困难查看答案及解析


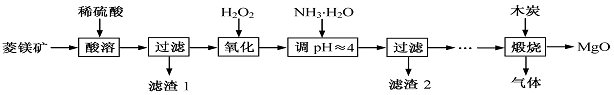 (1)MgCO3与稀硫酸反应的离子方程式为。
(1)MgCO3与稀硫酸反应的离子方程式为。