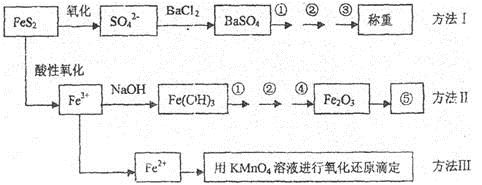
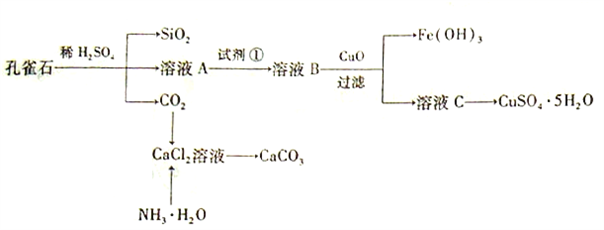
-
下列各项中所列举的物质与所属类别对应不正确的是
A. 酸性氧化物:
B. 非电解质:蔗糖、四氯化碳、氨气、氯气
C. 同素异形体:石墨与金刚石、单斜硫与斜方硫
D. 混合物:铝热剂、纯净矿泉水、水玻璃、焦炉气
难度: 简单查看答案及解析
-
下列家庭化学小实验不能达到预期目的的是
A. 用米汤检验食用加碘盐(含KIO3)中含有碘
B. 用醋、石灰水验证蛋壳中含有碳酸盐
C. 用碘酒检验汽油中是否含有不饱和烃
D. 用鸡蛋白、食盐、水完成蛋白质的溶解、盐析实验
难度: 简单查看答案及解析
-
①
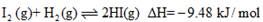
②
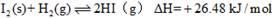
下列判断正确的是
A. 254g I2(g)中通入2g H2(g),反应放热9.48 kJ
B. 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C. 反应①的产物比反应②的产物稳定
D. 反应②的反应物总能量比反应①的反应物总能量低
难度: 简单查看答案及解析
-
化学与人们的生活、健康密切相关.下列做法不合理的是( )
A. 用米汤检验加碘食盐中的碘酸钾(KIO3)
B. 向豆浆中加入盐卤(主要成分为MgCl2)制做豆腐
C. 用灼烧和闻气味的方法区别棉织物和纯毛织物
D. 向污水中加入适量明矾,可除去其中的悬浮物
难度: 简单查看答案及解析
-
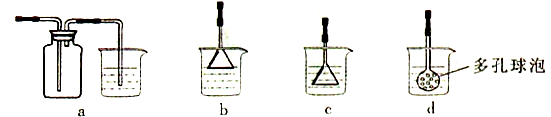
利用下图所示装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测其中现象正确的是
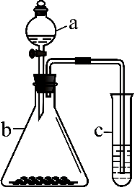
选项
a
b
c
c试管中现象
A
浓盐酸
KMnO4
FeCl2溶液
溶液变棕黄色
B
稀硫酸
Na2S2O3
溴水
产生浅黄色沉淀
C
硼酸
Na2CO3
Na2SiO3溶液
析出白色沉淀
D
浓硝酸
铁片
KI-淀粉溶液
溶液变蓝色
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列化学反应中的△H>O是( )
A.
══
B.
══
C.
══
D.
══
难度: 简单查看答案及解析
-
对可逆反应2A(s)+3B(g)
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动; ②升温,平衡向逆反应方向移动,v(正)减小;③压强增大一倍,平衡不移动,v(正)、v(逆)不变; ④增大B的浓度,v(正)>v(逆);⑤加入催化剂,B的转化率提高
A. ①② B. ④ C. ③ D. ④⑤
难度: 简单查看答案及解析
-
下列指定微粒的个数比为2:1的是
A. Be2+离子中的质子和电子 B.
H原子中的中子和质子
C. NaHCO3晶体中的阳离子和阴离子 D. Na2O2固体中的阴离子和阳离子
难度: 中等查看答案及解析
-
一定温度下,在固定容积的密闭容器中发生下列反应∶2HI(g)
H2(g)+I2(g)。若HI的浓度由0.1 mol • L-1降到0.07 mol • L-1时需要15s,则HI的浓度由0.07 mol • L-1降到0.05 mol • L-1时,所需时间为
A. 等于5s B. 等于10 s C. 大于10s D. 小于10 s
难度: 中等查看答案及解析
-
对于处于化学平衡状态的反应C(s) + H2O(g)
CO(g) + H2(g) △H>0,既要提高反应速率又要提高H2O的转化率,下列措施中可行的是( )
A. 增大H2O(g)的浓度 B. 降低压强 C. 升温 D. 使用合适的催化剂
难度: 中等查看答案及解析
-
设NA为阿伏加罗常数的值,下列说法正确的是( )
A. 17g羟基和17gOH-含有的电子数均为10NA
B. 2L0.5 mol•L-1醋酸溶液中含有的H+数为NA
C. 标准状况下,NA个NO分子和0.5NA个O2分子充分反应后气体体积为22.4L
D. 7.8gNa2O2与足量的CO2和H2O(g)混合气体充分反应,转移的电子数为0.1NA
难度: 中等查看答案及解析
-
已知:
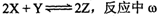 (Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是( )
(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是( )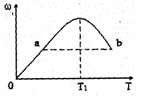
A. T1时,v正>v逆
B. 正反应的△H<0
C. a、b两点的反应速率va=vb
D. T<T1时,ω增大的原因是平衡向正方向移动
难度: 中等查看答案及解析
-
30mlCO2和NO混合气体通入足量的Na2O2固体并且充分反应后,气体体积变为20ml,则原混合气体中CO2体积为(同温同压下) ( )
A. 30mL B. 20mL C. 10mL D. 无法计算
难度: 中等查看答案及解析
-
下列化合物中,既含有离子键又含有共价键的是( )
A. H2O2 B. Na2O C. CO2 D. NaOH
难度: 中等查看答案及解析
-
A. 某温度时,化学反应速率无论用A、B、C何种物质表示,其数值是相同的
B. 其他条件不变,增大压强,反应速率加快
C. 若增加或减小B的物质的量,则反应速率一定会发生明显的变化
D. 其他条件不变,升高温度,反应速率加快
难度: 中等查看答案及解析
-
将足量的X气体通入Y溶液中,实验结果与预测的现象一致的组合是
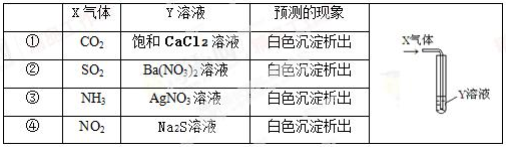
A. 只有①②③ B. 只有①② C. 只有② D. ②④
难度: 中等查看答案及解析
-
某溶液中Cl-、Br-、I-的物质的量之比是2:3:4,要使溶液中的Cl-、Br-、I-的物质的量之比为4:3:2,则通入氯气的物质的量是原溶液I-的物质的量的( )
A. 1∕2 B. 1∕4 C. 1∕6 D. 1∕8
难度: 困难查看答案及解析
-
下列实验能达到预期目的的是( )
实验内容
实验目的
A
向1 mL 0.1mol/L NaOH溶液中加入2 mL 0.1mol/L CuSO4溶液,振荡后滴加0.5 mL葡萄糖溶液,加热未出现红色沉淀
证明葡萄糖中含有醛基
B
向1 mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2
溶液,产生白色沉淀后,再滴加2滴0.1mol/L
FeCl3溶液,又生成红褐色沉淀
证明在相同温度下,Ksp[Mg(OH)2]>Ksp[Fe(OH)3]
C
测定同温度下相同浓度的碳酸钠和硫酸钠溶
液的pH,前者大于后者
证明碳元素非金属性弱于硫
D
向某溶液中滴加少量稀NaOH溶液,将湿润的红色石蕊
试纸置于试管口试纸不变蓝
证明溶液中无NH4+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
W、X、Y、Z是原子序数依次增大的短周期元素。m、n、p是由这些元素组成的二元化合物,r是元素Y的常见单质,能使带火星的木条复燃,q的水溶液呈碱性,0.0l mol·L-l s溶液的pH为12,q、s的焰色反应均呈黄色。上述物质的转化关系如图所示。下列说法正确的是( )
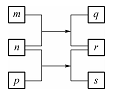
A. 原子半径:W<X<Y<Z
B. 通常状况下,X的氢化物可能呈气态、液态或固态
C. Y的氢化物的沸点比Z的氢化物的沸点高
D. 由W、X、Y、Z四种元素只能组成一种化合物
难度: 困难查看答案及解析
-
已知25℃时:①HF(aq)+OH-(aq)=F-(aq)+H2O(1)ΔH=-67.7kJ·mol-1,②H+(aq)+OH-(aq)=H2O(1) ΔH=-57.3kJ·mol-1。在20mL0.1mol·L-1氢氟酸中加入VmL0.1mol·L-1NaOH溶液,下列有关说法不正确的是
A. 氢氟酸的电离方程式及热效应可表示为: HF(aq)
F-(aq)+ H+(aq) ΔH=-10.4kJ·mol-1
B. 当V=20时,溶液中:c(OH-)=c(HF)+c(H+)
C. 当V=20时,溶液中:c(F-)<c(Na+)=0.1mol·L-1
D. 当V>0时,溶液中可能存在:c(Na+)>c(F-)>c(OH-)>c(H+)
难度: 极难查看答案及解析