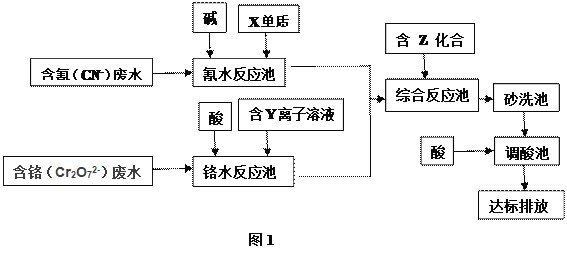
-
下列叙述正确的是( )
A. 直径介于1nm ~ 100nm之间的微粒称为胶体
B. 氮的固定只有在高温、高压、催化剂的条件下才能实现
C. 鸡蛋白溶胶中加入饱和硫酸铵溶液后有沉淀析出,该过程属于物理变化
D. 电泳现象可证明胶体属于电解质溶液
难度: 困难查看答案及解析
-
能正确表示下列反应的离子方程式为( )
A. 碳酸氢钠溶液中滴入足量氢氧化钙溶液:HCO3—+OH– = CO32—+ H2O
B. 硅酸钠溶液与足量CO2反应: SiO32—+CO2+H2O = H2SiO3↓+CO32—
C. FeBr2溶液中通入足量的Cl2:2Fe2++Cl2 = 2Fe3++2Cl—
D. 新制的氧化铝可溶于氢氧化钠溶液:Al2O3+2OH– = 2AlO2–+H2O
难度: 中等查看答案及解析
-
邻甲基苯甲酸有多种同分异构体,其中属于酯类且分子结构中有—CH3和苯环的同分异构体有( )
A. 6种 B. 5种 C. 4种 D. 3种
难度: 困难查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述中正确的是 ( )
A. S2和S8的混合物共6.4g,其中所含硫原子数为0.2NA
B. 足量的铜片与含4molHNO3的浓硝酸充分反应生成的二氧化氮的分子数为2NA
C. 5.6g铁粉与硝酸反应失去的电子数一定为0.3 NA
D. 30g甲醛中含有的共用电子对数为3NA
难度: 困难查看答案及解析
-
用下列装置进行实验能达到相应实验目的的是
A. 用该装置收集NO

B. 分离氢氧化铁胶体和氯化钠溶液
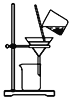
C. 实验室中制取少量蒸馏水
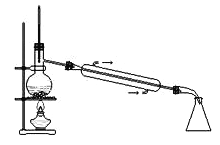
D. 配制100 mL 0.10 mol﹒L-1盐酸
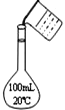
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是
A. 将饱和氯化铁溶液逐滴加入煮沸的蒸馏水中制备氢氧化铁胶体:Fe3+ + 3H2O
Fe(OH)3↓+ 3H+
B. 向FeBr2溶液中通入过量Cl2:2Fe2+ + 2Br- + 2Cl2 = 2Fe3++ Br2 + 4Cl-
C. 将NaHCO3溶液与过量的Ca(OH)2溶液混合:HCO3- + OH-+ Ca2+ = CaCO3↓+ H2O
D. 用KIO3氧化酸性溶液中的KI:5I- + IO3- + 3H2O = 3I2 + 6OH-
难度: 困难查看答案及解析
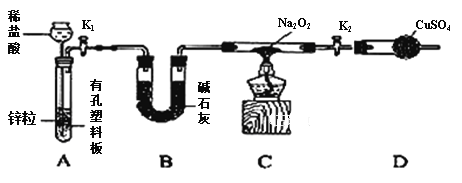
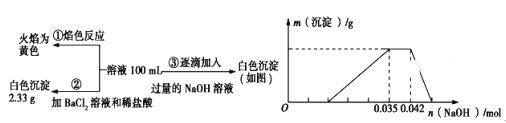
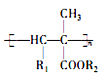 ,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下: