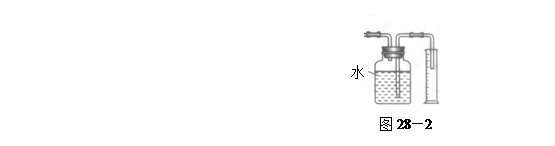-
生产、生活、医疗卫生等都离不开化学知识。下列说法错误的是
A.在硬水中,肥皂的去污能力减弱
B.世界各国流通的硬币材质一般都是合金
C.水泥、合成橡胶和人造纤维都属于有机高分子材料
D.加热能杀死甲型H1N1流感病毒是因为病毒的蛋白质受热变性
难度: 简单查看答案及解析
-
下列指定粒子的个数比一定为2:1的是
A.Be2+中的电子和质子 B.
中的中子和质子
C.Na2CO3溶液中的Na+和CO32- D.Na2O2固体中的阳离子和阴离子
难度: 简单查看答案及解析
-
下列大小顺序排列完全正确的组合是
①气态氢化物的稳定性:HF>NH3>PH3
②熔点:Na>C3H8>CH3OH
③离子半径:K+>Ca2+>S2—
④相同温度、相同浓度溶液中水的电离程度:NH4Cl>CH3COOH>HCl
A.①④ B.①② C.②③ D.③④
难度: 简单查看答案及解析
-
下列错误操作一定会导致实验结果偏高的是
A.用天平称量某物质时,右盘放物质,左盘放砝码,测得物质质量
B.配制一定物质的量浓度溶液,定容时仰视刻度线,所得溶液浓度
C.测定硫酸铜晶体结晶水含量时,在空气中冷却后称量,测得结晶水含量
D.用已知浓度的盐酸滴定未知浓度的NaOH溶液时,酸式滴定管用蒸馏水洗净后,直接装入盐酸进行滴定,测得碱液浓度
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A.偏铝酸钠溶液显碱性的原因:AlO2-+2H2O
Al(OH)3↓+OH-
B.过量的CO2通人Ca(ClO)2溶液中:CO2+ClO-+H2O=HCO3-+HClO
C.在银氨溶液中滴加过量稀硝酸:[Ag(NH3)2]+ +2H+ == Ag++2NH4+
D.水杨酸( )与过量的Na2CO3溶液混合:
+ HCO3—
+ CO32—
难度: 简单查看答案及解析
-
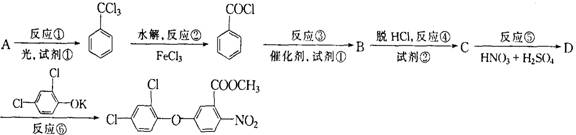
某些含羟基的药物具有苦味,如下图所示结构的氯霉素。此药物分子中碳链末端羟基中的氢原
子换成来自棕榈酸中的原子团“ ”后,苦味消失,成为便于口服的无味氯霉素。以下叙述中不正确的是

A.氯霉素可发生水解反应
B.棕榈酸与乙二酸互为同系物
C.无味氯霉素的水溶性比氯霉素的差
D.无味氯霉素在胃酸作用下可水解成氯霉素而起到疗效
难度: 简单查看答案及解析
-
已知:在加压时物质C容易液化。某温度下,向容积可变的容器中充入1mol A、2mol B,发生反应:A(g)+ B(g)
2C(g)+D(g);△H<0,建立平衡后,保持温度不变,增大加强,建立新平衡时,下列说法错误的是
A.v正(A)一定增大
B.B的转化率可能减小
C.△H一定不变
D.D的物质的量不可能超过1 mol
难度: 简单查看答案及解析
-
某CuSO4、H2SO4、Fe2(SO4)3的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42—的物质的量浓度为6mol/L,则此溶液最多可溶解铁粉的质量为
A.16.8g B.22.4g C.28g D.33.6g
难度: 简单查看答案及解析
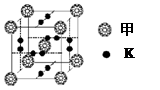 (2)若D是地壳中含量位居第二的元素,其单质是制造太阳能电池板的关键材料,其氧化物在数据传输方面贡献突出,则:
(2)若D是地壳中含量位居第二的元素,其单质是制造太阳能电池板的关键材料,其氧化物在数据传输方面贡献突出,则:
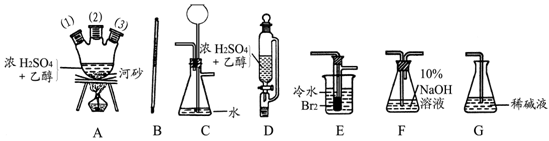
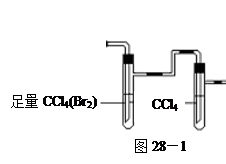 方案II:将E及其后面的装置拆除后,连接图28—2所示装置进行实验,反应结束后,测得乙烯的体积,由此算得乙烯产量。
方案II:将E及其后面的装置拆除后,连接图28—2所示装置进行实验,反应结束后,测得乙烯的体积,由此算得乙烯产量。