-
分类是科学研究的重要方法,下列物质分类不正确的是
A.化合物:干冰,冰水混合物,烧碱,小苏打
B.非电解质:乙醇,四氯化碳,氯气,葡萄糖
C.同素异形体:活性炭,C60,石墨烯,金刚石
D.混合物:铝热剂,纯净矿泉水,水玻璃,漂白粉
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.I的原子半径大于Br,HI比HBr的热稳定性弱
B.FeCl2、NaHSO3、Fe(OH)3 都可以通过化合反应直接制得
C.BaSO4、NaCl、NaHCO3均属于强电解质
D.水分子比较稳定,是因为水分子间存在氢键
难度: 中等查看答案及解析
-
下列物质在生活中应用时,起还原作用的是( )
A.明矾作净水剂 B.甘油作护肤保湿剂
C.漂粉精作消毒剂 D.铁粉作食品袋内的脱氧剂
难度: 简单查看答案及解析
-
以下物质间的转化通过一步反应都能实现的是( )
A.Si→SiO2→H2SiO3→Na2SiO3 B. HCl→Cl2→HClO→NaClO
C.S→SO3→H2SO4→Al2(SO4)3 D.NH3→NO2→HNO3→NaNO3
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4
B.Fe(OH)3胶体无色、透明,能发生丁达尔现象
C.H2、SO2、CO2三种气体都可用浓硫酸干燥
D.SiO2既能和氢氧化钠溶液反应也能和氢氟酸反应,所以是两性氧化物
难度: 中等查看答案及解析
-
配制一定体积、一定物质的量浓度的硫酸溶液时,下列情况使溶液浓度偏小的是
A.容量瓶中原有少量蒸馏水
B. 定容时观察液面仰视
C. 用量筒量取浓硫酸后洗涤量筒
D.稀释后未冷却至室温即定容
难度: 中等查看答案及解析
-
有Fe2+、NO3-、Fe3+、NH4+、H+ 和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
A.氧化剂与还原剂的物质的量之比为8:l
B、还原产物为NH4+
C.若有l mol NO3-参加还原反应,则转移8mol e-
D.若把该反应设计为原电池,则负极反应为Fe 2+-e-=Fe 3+
难度: 中等查看答案及解析
-
下列说法正确的是(设NA表示阿伏加德罗常数的值)
A.80℃时,1L pH=1的硫酸溶液中,含有0.2NA个H+
B.4.6gNa完全转化成Na2O和Na2O2的混合物,生成物中阴离子总数为0.1 NA
C.标准状况下,2.24LCl2溶于水,转移的电子数目为0.1NA
D.300mL 2mol/L蔗糖溶液中所含分子数为0.6NA
难度: 中等查看答案及解析
-
己知在碱性溶液中可发生如下反应:
2R(OH)3 + 3C1O- + 4OH- = 2RO4n-+3Cl- +5H2O则RO4n-中R的化合价是( )
A.+3 B +4 C.+5 D.+6
难度: 中等查看答案及解析
-
等物质的量的Na和Al两种金属加入足量的水中,生成26.88L(标准状况下)的气体,则下列描述错误的是( )
A.金属 Al无剩余 B.c (Na+)=c(AlO2-)
C.所得溶液呈碱性 D.Na的物质的量是0.6mol
难度: 中等查看答案及解析
-
向某二价金属M的M(OH)2溶液中加入过量的NaHCO3溶液,生成了MCO3沉淀,过滤,将沉淀置于足量的稀盐酸中,充分反应后,在标准状况下收集到V L气体,如果计算金属M的相对原子质量,你认为还必需提供下列哪项数据( )
A.M(OH)2溶液的物质的量浓度
B.与M CO3反应的盐酸的物质的量浓度
C.MCO3的质量
D.题给条件充足,不需要再补充数据
难度: 困难查看答案及解析
-
下列离子方程式中书写正确的一组是( )
① 向明矾溶液中加入Ba(OH)2溶液至A13+ 刚好完全沉淀:
Al3++ SO42-+3OH-+Ba2+= BaSO4↓+Al (OH)3↓
② 氟气和水反应:2F2+2H2O = 4H++4F-+O2
③ 向澄清石灰水中加入少量小苏打溶液:
Ca2++OH-+HCO3- = CaCO3↓+H2O
④ 铜片投入稀HNO3溶液:Cu+NO3-+4H+ = NO↑+2H2O+Cu2+
⑤ 钠与水反应:Na +2 H2O = Na+ +OH— + H2↑
⑥ 碳酸钙放入盐酸中: CO32- + 2H+ = CO2↑ +H2O
⑦ 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O
Fe(OH)3(胶体)+3H+
⑧ 过量氯水与FeI2溶液作用: 2Fe2+ + 2I—+ 2Cl2 = 2 Fe3+ + I2 + 4Cl—
A. ①②③④ B. ③⑦ C. ①③④⑤ D.①④⑥⑦⑧
难度: 极难查看答案及解析
-
某无色气体,可能含HCl、CO2、HI、SO2中的一种或几种,将其通入氯水中,得到无色透明溶液。把溶液分成两份,向一份中加入盐酸酸化的BaCl2溶液,出现白色沉淀;另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀生成。对于原无色气体推断一定正确的是( )
A.一定存在HCl B.一定存在SO2 C.肯定没有CO2 D.不能肯定是否含有HI
难度: 中等查看答案及解析
-
同温同压下,相同质量的SO2(气体)和SO3(气体)相比较,下列有关叙述正确是① 它们所含分子数目之比为4:5;② 它们所含氧原子数目之比为5:6;③ 它们所含原子总数之比为1:1;④ 它们所含的硫原子数目之比为5:4;⑤ 它们的密度之比为4:5
A.②③⑤ B.①④⑤ C.②④⑤ D.①②⑤
难度: 中等查看答案及解析
-
下列叙述不正确的是( )
① 熔点:金刚石>晶体硅>单质硫
② 气态氢化物的稳定性:H2O>HF>H2S
③ 同一主族元素的氢化物,相对分子质量越大,它的沸点一定越高
④ 因为常温下白磷可自燃,而氮气需要在放电时才与氧气反应,所以非金属性:P>N
⑤ 碱性氧化物一定是金属氧化物
A.①②③ B.②③④ C.②④⑤ D.①③⑤
难度: 中等查看答案及解析
-
纯净物X、Y、Z转化关系如右图所示,下列判断正确的是( )
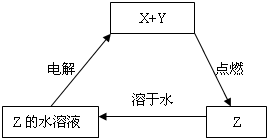
A.X可能是金属铜
B.Y不可能是氢气
C.Z可能是氯化钠
D.Z可能是三氧化硫
难度: 困难查看答案及解析
-
某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、Al3+、CO32–、Cl–、OH–、NO3–。向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有( )
A.3种 B.4种 C.5种 D.6种
难度: 困难查看答案及解析
-
下列反应中,调节反应物用量或浓度不会改变反应产物的是( )
①KHCO3溶液与石灰水反应,②Na2SO3溶液与稀盐酸反应,③Si与烧碱溶液反应,④Fe与稀硝酸反应,⑤金属钠在氧气中燃烧,⑥二氧化硫通入石灰水,⑦铁在硫蒸气中燃烧
A.①④⑦ B.①②④⑤ C.③⑤⑦ D.②③④⑦
难度: 中等查看答案及解析
-
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示)

下列有关说法不正确的是( )
A.从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能量的过程
B.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2
C.在过程③⑤中溴元素均被氧化
D.过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+ 等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
难度: 困难查看答案及解析
-
在含有Fe3+、Fe2+、Al3+、NH4+的稀溶液中,加入足量的Na2O2固体,充分反应后,再加入过量的稀盐酸,完全反应后,离子数目几乎没有变化的是( )
A.Fe3+ B.Al3+ C.NH4+ D.Fe2+
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中,一定能大量共存的是( )
A.能使pH试纸呈红色的溶液:Na+、NH4+、I—、NO3—
B.澄清透明溶液中:K+、Cu2+、Na+、Cl-
C.加入苯酚显紫色的溶液:K+、NH4+、Cl-、I-
D.常温下由水电离出的c(H+)=10-10mol·L-1的溶液:Na+、Cl-、ClO-、SO32-
难度: 中等查看答案及解析
-
若以w1和w2分别表示浓度为a mol∙L-1和b mol∙L-1氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小)( )
A.2 w1=w2 B.2 w2=w1 C.w2>2 w1 D.w1<w2<2 w1
难度: 困难查看答案及解析
-
甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、SO42-、HCO3-中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;② 0.1mol/L乙溶液中c(H+)>0.1mol/L;③ 向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是
A.甲溶液含有Ba2+ B. 乙溶液含有SO42-
C.丙溶液含有Cl- D.丁溶液含有Mg2+
难度: 困难查看答案及解析
-
下列实验不能达到目的的是
选项
实验操作
实验目的
A
皮肤上沾有苯酚,用氢氧化钠溶液洗涤
除皮肤上的苯酚
B
向适量样品溶液中滴加KSCN溶液
检验FeSO4溶液是否被氧化
C
向适量样品溶液中滴加盐酸酸化,再滴加BaCl2溶液
检验Na2SO3溶液是否被氧化
D
向Na2SiO3溶液中通入CO2
验证非金属性:碳>硅
难度: 中等查看答案及解析
-
用右图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
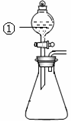
选项
①中物质
②中物质
预测②中的现象
A.
稀盐酸
碳酸钠与氢氧化钠的混合溶液
立即产生气泡
B.
浓硝酸
用砂纸打磨过的铝条
产生红棕色气体
C.
氯化铝溶液
浓氢氧化钠溶液
产生大量白色沉淀
D.
草酸溶液
高锰酸钾酸性溶液
溶液逐渐褪色
难度: 中等查看答案及解析
-
0.1mol下列气体分别与1L0.lmol·L-1的NaOH溶液反应,形成的溶液pH最小的是( )
A.NO2 B.SO2 C.SO3 D.CO2
难度: 中等查看答案及解析
-
下列物质见光不会分解的是( )
A.HClO B.NH4Cl C.HNO3 D.AgNO3
难度: 中等查看答案及解析
-
向1LFeBr2溶液中,通入1.12L(标准状况下)的Cl2,测得溶液中c(Br一)=3c(Cl一),反应过程中溶液的体积变化忽略不计,则下列说法中正确的是( )
A.原溶液的浓度为0.1mol/L B.反应后溶液中c(Fe3+)=0.1mol/L
C.反应后溶液中c(Fe3+)=c(Fe2+) D.原溶液中c(Br一)=0.4mol/L
难度: 极难查看答案及解析
-
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是( )
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
难度: 极难查看答案及解析
-
现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加bmol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中正确的有( )
①沉淀中氢氧根的质量为(n-m)克
②恰好溶解后溶液中的NO3-离子的物质的量为
mol
③反应过程中转移的电子数为
mol
④生成标准状况下NO气体的体积为
L
⑤与合金反应反应的硝酸的物质的量为(
+
)mol
A.2项 B.3项 C.4项 D.5项
难度: 极难查看答案及解析