-
目前有研究表明,过氧乙酸对甲型H1N1流感病毒有较好的杀菌作用,这主要是利用了过氧乙酸的 ( )
A.酸性 B.挥发性 C.还原性 D.强氧化性
难度: 简单查看答案及解析
-
将反应Mn2++BiO
+H+―→MnO
+Bi3++H2O配平后,H+的化学计 量数为 ( )
A.8 B.10 C.14 D.30
难度: 简单查看答案及解析
-
有下列几种粒子:OH-、HCO
、H+、NH
、NH3,其中能在水溶液中两两发生反应的共有 ( )
A.三组 B.四组 C.五组 D.六组
难度: 简单查看答案及解析
-
在某澄清、透明的浅黄色溶液中,可能含有下列八种离子:H+、NH、Fe3+、Ba2+、Al3+、SO、HCO、I-,在检验方案设计时初步分析其溶液中最多可含离子(不包括OH-)有 ( )
A.4种 B.5种 C.6种 D.7种
难度: 简单查看答案及解析
-
根据热化学方程式S(l)+O2(g)===SO2(g);ΔH=-293.23 kJ/mol.分析下列说法中正确的是 ( )
A.S(s)+O2(g)===SO2(g),反应放出的热量大于293.23 kJ/mol
B.S(g)+O2(g)===SO2(g),反应放出的热量小于293.23 kJ/mol
C.1 mol SO2的键能的总和大于1 mol 硫和1 mol 氧气的键能之和
D.1 mol SO2的键能的总和小于1 mol 硫和1 mol 氧气的键能之和
难度: 简单查看答案及解析
-
已知胆矾溶于水时,溶液温度降低.在室温下将1 mol无水硫酸铜制成溶液时,放出热量为Q1 kJ,而胆矾分解的热化学方程式是CuSO4·5H2O(s)===CuSO4(s)+5H2O(l);
ΔH=+Q2 kJ/mol,则Q1与Q2的关系是 ( )
A.Q1<Q2 B.Q1>Q2 C.Q1=Q2 D.无法确定
难度: 简单查看答案及解析
-
向含有0.078 mol FeCl2的溶液中通入0.009 mol Cl2,再加入含0.01 mol X2O
的酸性溶液,使溶液中的Fe2+恰好全部被氧化.并使X2O
还原为Xn+,则n的值为 ( )
A.2 B.3 C.4 D.5
难度: 简单查看答案及解析
-
已知:H2(g)+F2(g)===2HF(g);ΔH=-270 kJ/mol,下列说法正确的是: ( )
A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.在相同条件下1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D.该反应中的能量变化可用下图来表示
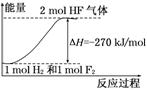
难度: 简单查看答案及解析
-
物质的量之比为2∶5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是 ( )
A.1∶4 B.1∶5 C.2∶3 D.2∶5
难度: 简单查看答案及解析
-
A、B两个烧杯中分别盛有100mL3.0mol/L的盐酸和烧碱溶液,向两个烧杯中分别加入等质量的Al粉,在相同条件下产生气体的体积比A : B=2 : 5,则加入铝粉的质量为( )
A.8.1g B.6.75g C.5.4g D.2.7 g
难度: 简单查看答案及解析
-
T℃时,将某硫酸铜溶液蒸发掉55克水,或向该溶液中加入25克胆矾,都能得到该温度下的硫酸铜饱和溶液,则该温度下硫酸铜的溶解度为(单位:克) ( )
A.45 B.25 C.29 D.39
难度: 简单查看答案及解析
-
用单分子油膜法测出油酸分子(视为球形)的直径后,还要下列哪一个物理量就可以计算出阿伏加德罗常数 ( )
A.油滴的体积 B.油滴的质量
C.1 mol油酸的体积 D.油酸的摩尔质量
难度: 简单查看答案及解析
-
设NA代表阿伏加德罗常数.下列说法正确的是 ( )
A.2.9 g 2CaSO4·H2O中含有的结晶水分子数为0.02NA
B.30 g乙酸和葡萄糖的混和物中含碳原子数为NA
C.在铁与硫的反应中,1 mol铁失去的电子数为3NA
D.62 g Na2O溶于水后所得溶液中含有的O2-数为NA
难度: 简单查看答案及解析
-
一定量某物质的溶液,其质量分数为0.2A,当加入等体积的水稀释后,其质量分数小于0.1A,则该溶液的密度 ( )
A.大于水的密度 B.小于水的密度 C.等于水的密度 D.无法确定
难度: 简单查看答案及解析
-
由CO、H2和O2组成的混合气体,在一定条件下恰好完全反应,测得生成物在101 kPa、120℃下对空气的相对密度为1.293,则原混合气体中CO所占体积分数为 ( )
A.1/3 B.2/3 C.1/2 D.1/6
难度: 简单查看答案及解析
-
76.8mg铜与适量浓硝酸反应,铜全部作用后,如果NO3-离子减少2×10-3mol,则溶液中H+离子同时减少 ( )
A.4.8×10-3mol B.4.4×10-3mol
C.3.2×10-3mol D.2.2×10-3mol
难度: 简单查看答案及解析
-
下列有关气体体积的叙述中,正确的是 ( )
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B.气体摩尔体积是指1摩尔任何气体所占的体积约为22.4L
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
难度: 简单查看答案及解析
-
某氧原子的质量为a g,12C原子的质量为b g,且NA表示阿氏常数,下列说法中正确的是: ( )
A.氧元素的相对原子质量为12a/b B.1mol该原子质量为bNAg
C.x g该氧原子所含电子数为8x/a D.y g 该氧原子的中子数一定为8y/a
难度: 简单查看答案及解析
-
有Xn+、Ym+、Zn-,已知它们各自带有的电荷数值m>n,且X、Y、Z三种原子的M电子层中的电子数均为奇数。若按X→Y→Z的顺序,下列说法中正确的是 ( )
A.它们的最高价氧化物的相应水化物的碱性依次减弱,酸性依次增强
B.它们的原子半径依次增大
C.它们的单质在常温、常压下的密度依次减小
D.它们的最高价氧化物的水化物都是强电解质
难度: 简单查看答案及解析
-
金属卤化物与卤素化合可生成多卤化物,如KI + I2
KI3,有关KI3的叙述中错误的是 ( )
A.I2在KI溶液中溶解度增大是由于生成了I3-
B.I3-在溶液中存在平衡:I3-
I2 + I-
C.KI3溶液遇淀粉不呈蓝色
D.将氯气通入KI3溶液中,I3-浓度减小
难度: 简单查看答案及解析
-
两种短周期元素组成的化合物中原子数比为1:3,若两种元素的原子序数分别是a和b,则a和b的关系可能是①a=b+5 ②a+b=8 ③a+b=30 ④a=b+8 ( )
A.①②③④ B.②③④ C.①②③ D.①③④
难度: 简单查看答案及解析
-
据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能给合质子的分子或离子都是碱,按照这种理论下列物质既属于酸又属于碱的是( )
A.NaCl B.H2O C.NaHSO4 D.Al2O3
难度: 简单查看答案及解析
-
下列离子方程式中正确的是 ( )
A.向NaHSO4溶液中滴加Ba(OH)2至SO42-沉淀完全2H+ + SO42- + Ba2+ + 2OH- = BaSO4↓+ 2H2O
B.碳酸钠溶液与醋酸反应:CO32- + 2H+ = CO2↑+ H2O
C.氢氧化亚铁与硝酸混合:Fe(OH)2 + 2H+ = Fe2+ + 2H2O
D.将1~2mL氯化铁饱和溶液加到20mL沸水中:Fe3+ + 3H2O = Fe(OH)3(胶体) + 3H+
难度: 简单查看答案及解析



