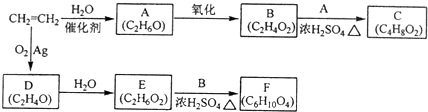
-
53131I是常规核裂变产物之一,可以通过测定大气或水中53131I的含量变化来检测核电站是否发生放射性物质泄漏.下列有关53131I的叙述中错误的是( )
A.53131I的化学性质与53127I相同
B.53131I的质子数为53
C.53131I的原子核外电子数为78
D.53131I的原子核内中子数多于质子数难度: 中等查看答案及解析
-
下列化合物中,在常温常压下以液态形式存在的是( )
A.甲醇
B.乙炔
C.丙烯
D.丁烷难度: 中等查看答案及解析
-
用0.1026mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为( )

A.22.30mL
B.22.35mL
C.23.65mL
D.23.70mL难度: 中等查看答案及解析
-
下列固体混合物与过量的稀H2SO4反应,能产生气泡并有沉淀生产的是( )
A.NaHCO3和Al(OH)3
B.BaCl2和NaCl
C.HClO3和K2SO4
D.Na2SO3和BaCO3难度: 中等查看答案及解析
-
已知:2Zn(s)+O2(g)=2ZnO(s);△H=-701.0kJ•mol-1
2Hg(l)+O2(g)=2HgO(s);△H=-181.6kJ•mol-1
则反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的△H为( )
A.+519.4kJ•mol-1
B.+259.7 kJ•mol-1
C.-259.7kJ•mol-1
D.-519.4kJ•mol-1难度: 中等查看答案及解析
-
一种充电电池放电时的电极反应为:H2+2OH--2e-=2H2O;NiO(OH)+H2O+e-=Ni(OH)2+OH-当为电池充电时,与外电源正极连接的电极上发生的反应是( )
A.H2O的还原
B.NiO(OH)的还原
C.H2的氧化
D.Ni(OH)2的氧化难度: 中等查看答案及解析
-
下列化合物的分子中,所有原子都处于同一平面的有( )
A.乙烷
B.甲苯
C.氟苯
D.四氯乙烯难度: 中等查看答案及解析
-
对于可逆反应H2(g)+I2(g)⇌2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( )
A.H2(g)的消耗速率与HI(g)的生成速率之比为2:1
B.反应进行的净速率是正、逆反应速率之差
C.正、逆反应速率的比值是恒定的
D.达到平衡时,正、逆反应速率相等难度: 中等查看答案及解析
-
“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用.如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示(部分条件及物质未标出).
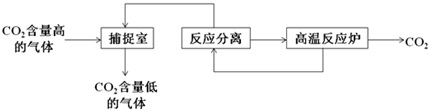
下列有关该方法的叙述中正确的是( )
A.能耗大是该方法的一大缺点
B.整个过程中,只有一种物质可以循环利用
C.“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤
D.该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品难度: 中等查看答案及解析
-
设NA是阿伏伽德罗常数的数值,下列说法正确的是( )
A.1mol Al3+离子含有的核外电子数为3NA
B.1mol Cl2与足量的铁反应,转移的电子数为3NA
C.10L pH=1的硫酸溶液中含有的H+离子数为2NA
D.10L pH=13的NaOH溶液中含有的OH-离子数为NA难度: 中等查看答案及解析
-
某反应的△H=+100kJ•mol-1,下列有关该反应的叙述正确的是( )
A.正反应活化能小于100kJ•mol-1
B.逆反应活化能一定小于100kJ•mol-1
C.正反应活化能不小于100kJ•mol-1
D.正反应活化能比逆反应活化能大100kJ•mol-1难度: 中等查看答案及解析
-
根据图,下列判断中正确的是( )

A.烧杯a中的溶液pH升高
B.烧杯b中发生氧化反应
C.烧杯a中发生的反应为2H++2e-═H2
D.烧杯b中发生的反应为2Cl--2e-═Cl2难度: 中等查看答案及解析
-
下列化合物中,核磁共振氢谱只出现两组峰且峰面积之比为3:2的是( )
A.
B.
C.
D.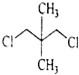
难度: 中等查看答案及解析
-
下列分子中,属于非极性的是( )
A.SO2
B.BeCl2
C.BBr3
D.COCl2难度: 中等查看答案及解析