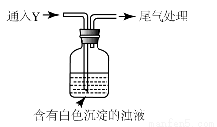
-
下列化学事实及其解释都正确的是
A.滴有酚酞的碳酸氢钠溶液显红色,微热后红色加深,是因为碳酸氢钠分解生成了碳酸钠
B.用洁净的玻璃管向包有过氧化钠的脱脂棉吹气,脱脂棉燃烧,说明二氧化碳、水与过氧化钠的反应是放热反应
C.向溴水中滴入植物油,振荡后油层显无色,说明溴不溶于油脂
D.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强
难度: 简单查看答案及解析
-
已知:碘单质能与I-反应成I3-,并在溶液中建立如下平衡:I2+I
I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。某同学为测定上述平衡体系中C(I2),采用如下方法:取V1mL平衡混合溶液,用cmol•L-1的Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗V2mL的Na2S2O3溶液。根据V1、V2和c可求得c(I2)。下列对该同学设计方案的分析,正确的是
A.方案可行,能准确测定溶液中的c(I2)
B.方案可行,可采用淀粉做该滴定反应的指示剂
C.不可行,只能测得溶液中c(I2)与c(I3-)之和
D.不可行,因为I-能与Na2S2O3溶液反应
难度: 简单查看答案及解析
-
0.1mol金属锡跟100mL12mol/LHNO3共热一段时间,完全反应后放出气体0.4mol,测定溶液c(H+)=8mol/L,溶液体积仍为100mL。由此推断氧化产物可能是
A.Sn(NO3)2 B.Sn(NO3)4
C.SnO2•4H2O D.Sn(NO3)2和Sn(NO3)4
难度: 困难查看答案及解析
-
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)
CO2+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min
n(CO)/mol
H2O/mol
0
1.20
0.60
t1
0.80
t2
0.20
下列说法正确的是
A.反应在t1min内的平均速率为v(H2)=0.40/t1 mol•L-1•mim-1
B.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,0.4molH2,则v(正)>v(逆)
D.保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,到达平衡时n(CO2)=0.40mol
难度: 困难查看答案及解析
-
分子中碳与氢元素的质量比为21:4的烃中,主链上有5个碳原子的结构共有几种
A.5 B.6 C.4 D.3
难度: 简单查看答案及解析
-
常温下,向等体积、等物质的量浓度的盐酸、醋酸溶液中分别滴入0.1mol/LNaOH溶液,测得溶液的pH与NaOH溶液体积的关系如图所示。下列说法错误的是
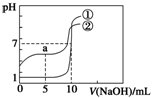
A.图中曲线①表示NaOH溶液滴定盐酸时的pH变化
B.酸溶液的体积均为10 mL
C.a点:c(CH3COOH)>c(CH3COO-)
D.a点:c(H+)+c(Na+)=c(OH-)+c(CH3COO-)
难度: 困难查看答案及解析
-
在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是
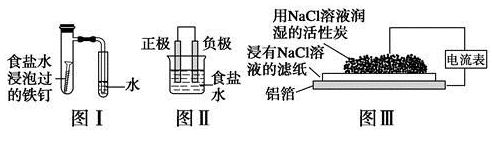
A.按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B.图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-=Cl2↑
D.图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑
难度: 困难查看答案及解析