-
下列物质分类的正确组合是
碱
酸
盐
酸性氧化物
A.
纯碱
盐酸
烧碱
二氧化硫
B.
烧碱
硫酸
食盐
一氧化碳
C.
氨水
醋酸
石灰石
二氧化碳
D.
苛性钾
碳酸
胆矾
三氧化硫
难度: 中等查看答案及解析
-
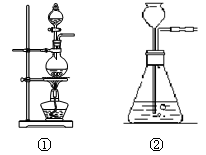
在自来水蒸馏实验中,下列叙述正确的是
A.在蒸馏烧瓶中盛满自来水,并放入几粒沸石
B.将温度计水银球插到蒸馏烧瓶自来水中
C.冷水从冷凝器上口入,下口出
D.收集到的液体取少量滴入硝酸银和稀硝酸,无明显现象
难度: 中等查看答案及解析
-
下列说法不正确的是
A.6.02×1023就是阿伏加德罗常数
B.0.012 kg C12含有的碳原子数就是阿伏加德罗常数的值
C.含有阿伏加德罗常数个粒子的物质的量是1 mol
D.1 mol NH3所含原子数约是2.408×1024
难度: 中等查看答案及解析
-
我国科学家通过测量SiO2中26Al和10Be两种元素的比例来确定“北京人”年龄,这种测量方法叫“铝铍测年法”。下列有关26Al和10Be的说法正确的是
A.10Be和9Be是中子数不同质子数相同的同种核素
B.10Be的原子核内质子数等于中子数
C.5.2 g 26Al3+中所含的电子数约为1.2×1024
D.26Al和26Mg的质子数和核外电子数均不同,中子数相同
难度: 中等查看答案及解析
-
分类是化学研究中常用的方法。下列分类方法中,正确的是
A.根据元素原子最外层电子数的多少将元素分为金属和非金属
B.依据组成元素的种类,将纯净物分为单质和化合物
C.根据氧化物中是否含有金属元素,将氧化物分为碱性氧化物和酸性氧化物
D.根据分散系的稳定性大小,将分散系分为胶体、浊液和溶液
难度: 中等查看答案及解析
-
下列离子检验的方法正确的是
A.某溶液
产生白色沉淀,说明原溶液中有Cl-
B.某溶液
产生白色沉淀,说明原溶液中有SO42-
C.某溶液
产生蓝色沉淀,说明原溶液中有Cu2+
D.某溶液
生成无色气体,说明原溶液中有CO32-
难度: 中等查看答案及解析
-
下列各组离子在溶液中能大量共存,加入OH-有沉淀生成,加入H+有气体生成的一组离子是
A.K+、Mg2+、Cl-、HCO3- B.K+、Cu2+、SO42-、Na+
C.NH4+、CO32-、NO3-、Na+ D.NH4+、Cl-、HCO3-、K+
难度: 中等查看答案及解析
-
下列说法正确的是
A.在氧化还原反应中,氧化剂经化学变化变成还原剂
B.在氧化还原反应中,氧化剂被氧化,还原剂被还原
C.在化学反应中,能把其他物质氧化的物质是氧化剂
D.在氧化还原反应中,还原剂生成的氧化产物一定只具有氧化性
难度: 中等查看答案及解析
-
某地甲、乙两厂排放的污水中各含有下列8种离子中的4种(两厂废水所含离子不同):Ag+、Ba2+、Fe2+、Na+、Cl-、SO42-、NO3-、OH-。若两厂单独排放污水都会造成严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便能变得无色澄清,溶质主要含硝酸钠,污染程度大大降低。根据所给信息有以下几种说法,你认为正确的是
A.Na+和NO3-来自同一工厂 B.Cl-和NO3-一定来自同一工厂
C.Ag+和Na+可能来自同一工厂 D.SO42-和OH-一定来自同一工厂
难度: 中等查看答案及解析
-
运动会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白烟。撞击时发生反应的化学方程式为:5KClO3+6P===3P2O5+5KCl,则下列有关叙述错误的是
A.上述反应中Cl的化合价由+5价变为-1价
B.P2O5是P被还原后所得的产物
C.该反应被还原与被氧化物质的物质的量之比为5∶6
D.上述反应中消耗3 mol P时,转移电子的物质的量为15 mol
难度: 中等查看答案及解析
-
下列关于物质的量浓度表述正确的是
A.0.3 mol•L﹣1的Na2SO4溶液中含有Na+和SO42﹣的总物质的量为0.9 mol•L﹣1
B.当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol•L﹣1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol•L﹣1
C.在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42﹣的物质的量相等,则K+和Cl﹣的物质的量浓度一定相同
D.10℃时,100 mL 0.35 mol•L﹣1的KCl饱和溶液蒸发掉5 g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol•L﹣1
难度: 中等查看答案及解析
-
关于胶体和溶液的区别,下列叙述中正确的是
A.溶液是透明的,胶体是不透明的
B.溶液中溶质粒子能通过滤纸,胶体中分散质粒子不能通过滤纸
C.溶液中通过一束光线没有特殊现象,胶体中通过一束光线出现明显光带
D.溶液稳定,放置后不会生成沉淀,胶体不稳定,放置会生成沉淀
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列有关说法正确的是
A.在常温常压下,11.2LN2含有的分子数小于0.5NA
B.标准状况下,2.24LSO3含有的原子数为0.4NA
C.将1L 2 mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA
D.46gNO2和N2O4混合气体所含氧原子数目有可能为3NA
难度: 中等查看答案及解析
-
化学工作者从有机反应:RH+Cl2(g)
RCl(l)+HCl(g)受到启发,提出的在农药和有机合成工业中可获得副产品盐酸的设想已成为现实.其中“g”代表气态,“l”代表液态,试指出从上述反应产物中分离得到盐酸的最佳方法是
A.蒸馏法 B.水洗分液法 C.升华法 D.有机溶剂萃取法
难度: 中等查看答案及解析
-
下列叙述正确的是
A.NaHCO3与石灰水反应,当n(NaHCO3)∶n[Ca(OH)2]=3∶1时,溶液中无HCO3-
B.CO2通入石灰水中,当n(CO2)∶n[Ca(OH)2]=1∶1时,能得到澄清溶液
C.等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-
BaSO4↓+2H2O
D.向碳酸氢钠溶液中滴入过量澄清石灰水:Ca2++OH-+HCO3-
CaCO3↓+H2O
难度: 中等查看答案及解析
-
某溶液中含有较大量的Cl-、CO32-、OH-等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③ B.④②①②③
C.①②③②④ D.④②③②①
难度: 中等查看答案及解析
-
下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是
A.氢氧化钠与盐酸;氢氧化钾与醋酸
B.Na2CO3溶液与KHSO4溶液;K2CO3溶液与HCl溶液
C.MgCl2溶液与NaOH溶液;Ba(OH)2溶液与MgSO4溶液
D.氧化钠与盐酸混合;氧化铜与稀盐酸
难度: 中等查看答案及解析
-
下列各组中的两物质作用时,反应条件(温度、反应物用量比)改变,不会引起产物的种类改变的是
A.Na和O2 B.NaOH和CO2 C.Na2O2和CO2 D.C和O2
难度: 中等查看答案及解析
-
12ml0.1mol/L的亚硫酸(H2SO4)溶液,恰好跟20ml浓度为0.02mol/L的重铬酸钾(K2Cr2O7)溶液完全反应,则元素铬(Cr)在还原产物中的化合价是
A.+1 B.+2 C.+3 D.+6
难度: 中等查看答案及解析
-
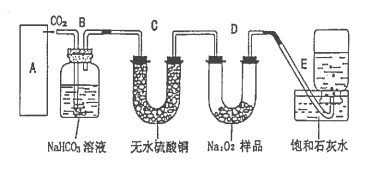
将含有O2和CH4的混合气体置于盛有23.4gNa2O2的密闭容器中,不断用电火花点燃,反应结束后,容器内的压强为零(150℃),将残留物溶于水中,无气体产生。下列叙述正确的是
A.原混合气体中O2和CH4的体积比为2∶1 B.残留物只有Na2CO3
C.原混合气体中O2与CH4的体积比为1∶1 D.残留物只有Na2CO3和NaOH
难度: 中等查看答案及解析
-
关于O2与O3气体,下列比值一定为2:3的是
A.若两种气体所占体积相同,两种气体的质量之比
B.若温度和压强相同,两种气体的密度之比
C.若两种两种气体原子数相同,两种气体的质子数之比
D.若两种气体的质量相同,两种气体的分子数之比
难度: 中等查看答案及解析
-
将NaCl和NaBr的混合物mg,溶于足量的水配成500mL溶液A,再向其中通入足量的Cl2,充分反应后将溶液蒸干,得固体(m-2)g,则A溶液中Na+、Br-、Cl—的物质的量浓度之比不可能是
A.3 :2 :1 B.3 :1 :2
C.4 :3 :2 D.5 :1 :4
难度: 中等查看答案及解析
-
将12mol/L的盐酸(ρ=1.19g/cm3)50mL稀释成6mol/L的盐酸(ρ=1.10g/cm3),需加水的体积为
A. 50mL B. 50.5mL C. 55mL D. 59.5mL
难度: 中等查看答案及解析
-
有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)/mol·L-1为
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
难度: 中等查看答案及解析
-
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水反应的化学方程式是:4K2FeO4+10H2O=4Fe(OH)3(胶体)+3O2↑+8KOH 工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O
干法制备:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法中错误的是
A.高铁酸钾处理水时,高铁酸钾发生还原反应
B.湿法中每生成1mol Na2FeO4共转移3mol电子
C.干法中每生成1mol Na2FeO4共转移4mol电子
D.K2FeO4处理水时,不仅能杀菌,并使悬浮杂质沉降
难度: 中等查看答案及解析