-
下列说法正确的是( )
A.需要加热的反应一定是吸热反应
B.所有的化学反应都有能量变化
C.所有的放热反应都可以在常温常压下自发进行
D.核能作为一种反应热,是理想的新能源
难度: 中等查看答案及解析
-
已知H2(g) + Cl2(g) == 2HCl(g);△H= –184.6 kJ·
,则反应 HCl(g)=
H2(g) +
Cl2(g) 的△H为( )
A.+184.6 kJ·
B.–923kJ·
C.–369.2 kJ·
D.+92.3 kJ·
难度: 中等查看答案及解析
-
已知反应:①101
时,
②稀溶液中:
下列说中正确的是( )
A.若碳的燃烧热用
表示,则
B.若碳的燃烧热用
表示,则
C.浓硫酸与稀
溶液反应的中和热值为57.3kJ·mol-1
D.稀醋酸与稀
溶液反应生成1mol水,放出57.3kJ的热量
难度: 中等查看答案及解析
-
甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5KJ热量,则下列热化学方程式中正确的是( )
A.2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l);ΔH== +890KJ·mol—1
B. CH4(g) + 2O2(g) == CO2(g) +2H2O(l);ΔH== +890KJ·mol—1
C. CH4(g) + 2O2(g) == CO2(g) +2H2O(l);ΔH== -890KJ·mol—1
D. 2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l);ΔH== -890KJ·mol—1
难度: 中等查看答案及解析
-
已知450℃时,反应H2(g)+I2(g)
2HI(g)的K=50,由此推测在450℃时,反应
2HI(g)
H2(g)+I2(g)的化学平衡常数为( )
A.50 B.0.02 C.100 D.无法确定
难度: 中等查看答案及解析
-
对于反应:N2+O2
2NO,在密闭容器中进行,下列条件能加快反应速率的是( )
A.缩小体积使压强增大
B.降低体系温度
C.体积不变充入He使气体压强增大
D.保持总压强不变,充入Ne气体
难度: 中等查看答案及解析
-
某温度下的定容密闭容器中,进行可逆反应:A(s)+2B(g)
C(g)+D(g),当下列物理量不发生变化时:①混合气体的密度;②容器内气体的压强;③混合气体的平均相对分子质量;④B的物质的量浓度。则能表明该反应一定已达到平衡状态的是( )
A.只有④ B.②③ C.②③④ D.①③④
难度: 中等查看答案及解析
-
体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2
2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率( )
A、等于p% B、大于p% C、小于p% D、无法判断
难度: 中等查看答案及解析
-
在一密闭容器中,反应aA(g)
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了
B.物质A的转化率减少了
C.物质B的质量分数减小了
D.a>b
难度: 中等查看答案及解析
-
在一定条件下,可逆反应:N2(g)+3H2(g)
2NH3(g),△H<0,达到平衡时,当单独改变下列条件后,有关叙述错误的是( )
A.加催化剂V正、V逆都发生变化且变化的倍数相等
B.加压,V正、V逆都增大,且V正增大倍数大于V逆增大倍数
C.降温,V正、V逆都减小,且V正减小倍数小于V逆减小倍数
D.加入氩气,V正、V逆都增大,且V正增大倍数大于V逆增大倍数
难度: 中等查看答案及解析
-
.在密闭容器中进行下列反应:M(g)+N(g)
R(g)+2L,此反应符合下面图像,下列叙述正确的是( )

A. 正反应吸热,L是气体
B. 正反应吸热,L是固体
C. 正反应放热,L是气体
D. 正反应放热,L是固体或液体
难度: 中等查看答案及解析
-
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是( )
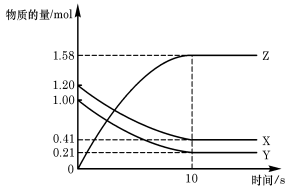
A.应开始到10 s时,Y的转化率为79.0%
B.应的化学方程式为:X(g)+Y(g)=Z(g)
C.应开始到10 s,用Z表示的反应速率为0.158mol/(L·s)
D.开始到10 s,X的物质的量浓度减少了0.79mol/L
难度: 中等查看答案及解析
-
在一密闭容器中有如下反应:aX(g)+bY(g)
nW(g);ΔH=Q某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:其中,ω(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是( )
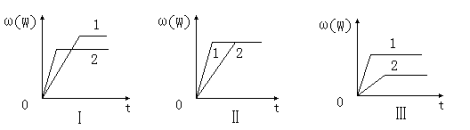
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b>n
B.图Ⅲ可能是不同温度对反应的影响,且T1>T2,Q<0
C.图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b
D.图Ⅱ可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好
难度: 中等查看答案及解析
-
在一个固定体积的密闭容器中,加入2molA和1molB发生反应:2A(g)+B(g)
3C(g)+D(g)达到平衡时,C的浓度为amol/L.若维持容器体积和温度不变,按下列四种配比为起始物质,达平衡后,C的浓度仍为amol/L的是( )
A. 4molA + 2mol B
B. 2molA + 1molB + 3molC + 1molD
C. 3molC + 1molD + 1molB
D. 3molC + 1molD
难度: 困难查看答案及解析
-
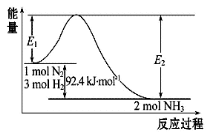
已知常温下,N2(气)和H2(气)生成2mol NH3(气)放出92.4 kJ热量。现有甲、乙两个容积相同的密闭容器,在常温下:①向密闭容器甲中通入1 molN2和3 mol H2,达到平衡时放出热量Q1kJ。②向密闭容器乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2kJ。则下列关系式正确的是
A.Q1=2Q2=92.4 B.Ql>2Q2 C.Q1<2Q2 D.Q1=2Q2≠92.4
难度: 中等查看答案及解析
-
T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
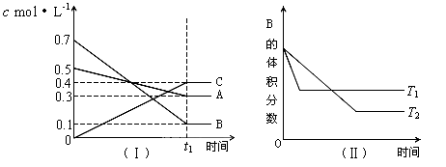
A.在t1min时,3V正(B)=2V逆(C)
B.(t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动
C.T℃时,在相同容器中,若由0.3mol·L—1 A、0.1 mol·L—1 B和0.4 mol·L—1 C反应,达到平衡后,C的浓度仍为0.4 mol·L—1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
难度: 中等查看答案及解析