-
下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;
④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,正确的是 ( )
A.由水电离的c(H+):①=②>③=④
B.将②、③两种溶液混合后,若pH=7,则消耗溶液的体积:②>③
C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D.向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>①>②
难度: 简单查看答案及解析
-
已知在1×105Pa、298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A.H2O(g)=H2(g)+1/2 O2(g); △H= +242kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l); △H= -484kJ·mol-1
C.H2(g)+1/2 O2(g)=H2O(g); △H= +242kJ·mol-1
D.2H2(g)+O2(g)=2H2O(g); △H= -242kJ·mol-1
难度: 简单查看答案及解析
-
下列热化学方程式中△H代表燃烧热的是 ( )
A.CH4(g)+3/2O2(g)=2H2O(g)+CO(g) △H1
B.S(s)+3/2O2(g)=SO3(s) △H2
C.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) △H3
D.2CO(g)+O2(g)=2CO2(g) △H4
难度: 简单查看答案及解析
-
在一定温度时,N2与H2反应过程中能量变化的曲线如图。
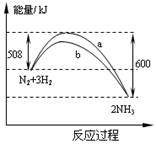
下列叙述正确的是( )
A.该反应的热化学方程式为:N2+3H22NH3 ΔH = -92 kJ/mol
B.b曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的放热增多
D.加入催化剂可增大正反应速率,降低逆反应速率
难度: 简单查看答案及解析
-
20℃时,将0.1 mol·L-1Na2S2O3溶液10 mL和0.01 mol·L-1 H2SO4溶液10 mL混合,
2 min后溶液中明显出现浑浊,已知温度每升高10℃,化学反应速率增大到原来的2倍,
那么50℃时,同样的反应要看到同样的浑浊,需要的时间是 ( )
A.40 s B.15 s
C.48 s D.20 s
难度: 简单查看答案及解析
-
在一固定容积的容闭容器中,加入2 L X 和3 L Y 气体,发生如下反应:
n X(g) + 3Y(g)
2Z(g) + R(g),反应平衡时,则知X 和Y 的转化率分别为30%和60%,则化学方程式中的n 值为 ( )
A.1 B.2 C.3 D.4
难度: 简单查看答案及解析
-
在给定的四种溶液中加入以下各种离子,各离子能在原溶液中大量共存的是( )
A.滴加甲基橙试液显红色的溶液 Fe3+、NH4+、Cl-、SCN-
B.水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO3-、Br-、Ba2+
C.pH值为1的溶液 Cu2+、Na+、Mg2+、NO3-
D.所含溶质为Na2SO4的溶液 K+、HCO3-、NO3-、H+
难度: 简单查看答案及解析
-
常温时,将pH=3的盐酸和pH=11的氨水等体积混合后,所得的溶液pH ( )
A.等于7 B.大于7 C.小于7 D.无法确定
难度: 简单查看答案及解析
-
0.1 mol·L-1盐酸分别跟20 mL NaOH和20 mL NH3·H2O反应,都消耗了20 mL 盐酸,这表明NaOH溶液和氨水的关系 ( )
A.物质的量浓度相同 B.氢氧根离子浓度相同
C.pH相同 D.溶液中离子浓度相同
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.物质燃烧都是放热反应 B.化学反应总是伴随着能量的变化
C.化学反应中需要加热的反应一定是吸收反应 D.化学反应中放出的热量就是反应热
难度: 简单查看答案及解析
-
关于用水制取二级能源氢气,以下研究方向正确的是( )
A.构成水的氢和氧都是可以燃烧的物质,因此,可研究在水不分解的情况下,使氢成为二级能源
B.设法将太阳光聚集,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊化学物质,用于开发廉价能源,以分解水制取氢气
难度: 简单查看答案及解析
-
对于可逆反应A(g)+2B(g)
2C(g)(正反应吸热),下列图象中正确的是( )
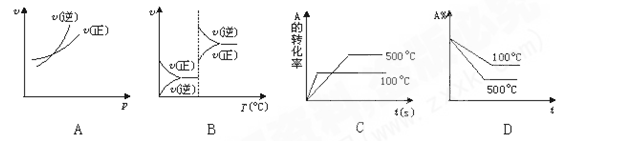
难度: 简单查看答案及解析
-
下列对化学平衡移动的分析中,不正确的是( )
①已达平衡的反应C(s)+H2O(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应达平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①②④ B.①②③ C.②③④ D.①②③④
难度: 简单查看答案及解析
-
已知NaHSO4在水中的电离方程式为:NaHSO4===Na++H++SO。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。对于该溶液,下列叙述中不正确的是 ( )
A.该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好呈中性
B.水电离出来的c(H+)=1×10-10mol·L-1
C.c(H+)=c(OH-)+c (SO)
D.该温度低于25℃
难度: 简单查看答案及解析