-
只用一种试剂就可一次性鉴别稀H2SO4、KOH溶液、CaCl2溶液的是
A KCl溶液 B K2CO3溶液 C稀盐酸 D NaNO3溶液
难度: 中等查看答案及解析
-
酸具有一些相似的化学性质,这是因为
A.酸能使指示剂变色
B.酸能跟碱反应生成盐和水
C.酸溶液能导电
D.酸溶液中含有H+
难度: 简单查看答案及解析
-
粗盐提纯的实验中,主要操作步骤正确的是( )
A.过滤、溶解、蒸发 B.溶解、蒸发、过滤
C.蒸发、溶解、过滤 D.溶解、过滤、蒸发
难度: 中等查看答案及解析
-
对于化学反应A+B=C+D,下列说法错误的是( )
A. 若A,B为化合物,则C,D也一定是化合物
B. 若A,C为单质,B,D为化合物,则该反应一定是置换反应
C. 若该反应为复分解反应,则生成物C,D可能均为沉淀物
D. 若D物质是H2O,该反应可能是复分解反应
难度: 中等查看答案及解析
-
要除去氯化钙溶液中的少量盐酸,使溶液变为中性,在没有指示剂的情况下,应选的试剂是( )
A. 氢氧化钙 B. 氢氧化钠 C. 碳酸钙 D. 硝酸银溶液
难度: 困难查看答案及解析
-
下列四种物质中,有一种物质的溶液能跟其他三种物质的溶液反应,这种物质是
A. NaOH B. Na2CO3 C. H2SO4 D. BaCl2
难度: 中等查看答案及解析
-
下列各组物质,只用水不能进行鉴别的是 ( )
A. NaOH、NH4NO3 B. CaCO3、Mg(OH)2
C. CaO、Ca(OH)2 D. CuSO4、Fe2(SO4)3
难度: 中等查看答案及解析
-
下列各组离子在水溶液中能大量共存的是( )
A. Fe2+、Ca2+、CO32-、OH- B. Na+、SO42-、Cl-、OH-
C. Ba2+、H+、Cl-、OH- D. Ag+、NH4+、NO3-、OH-
难度: 中等查看答案及解析
-
农作物缺钾时,抗病虫害和抗倒伏能力降低,此时应该施用的化肥是( )
A.KCl B.Ca3(PO4)2 C.NH4Cl D.CO(NH2)2
难度: 中等查看答案及解析
-
下列物质中,既属于碱类,又可作为化学肥料的是( )
A. 氨水 B. 熟石灰 C. 氯化铵 D. 磷酸钙
难度: 中等查看答案及解析
-
下列没有运用中和反应原理的是( )
A. 治理胃酸过多可服用含氢氧化镁的药物
B. 用熟石灰改良酸性土壤
C. 蚊虫叮咬处涂上肥皂水,可减轻痛痒
D. 用稀盐酸除去水垢
难度: 中等查看答案及解析
-
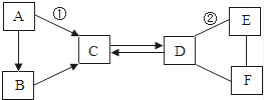
如图是某同学学习了氢氧化钠的化学性质后绘制的知识网络图,其中A、B、C分别表示不同类别的化合物,已知A是一种硫酸盐,其溶液呈蓝色,C是人体胃液中的酸,“—”表示相连两物质之间能相互反应。下列说法错误的是

A.若指示剂是紫色石蕊,则紫色石蕊遇氢氧化钠溶液变成蓝色
B.A物质与氢氧化钠溶液反应有白色沉淀产生
C.B物质可能是二氧化碳
D.C物质与氢氧化钠发生的是中和反应
难度: 困难查看答案及解析
-
下列物质的溶液一般不与其他物质发生复分解反应的是( )
A. KNO3 B. NaCl C. Cu(OH)2 D. MgSO4
难度: 中等查看答案及解析
-
下列物质存放在烧杯中,一段时间后,质量变大且变质的是( )
①浓盐酸 ②浓硫酸 ③烧碱 ④铁粉 ⑤生石灰 ⑥食盐
A. ① ⑥ B. ②③④⑤ C. ③④⑤ D. ②③④
难度: 中等查看答案及解析
-
向稀硫酸中加入下列物质,溶液的pH没有明显变化的是
A.铁 B.氧化铜 C.氯化钡 D.氢氧化钠
难度: 简单查看答案及解析
-
除去下列物质中的少量杂质(括号内为杂质)所用除去杂质的方法正确的是( )
选项
待提纯的物质
除去杂质的方法
A
KCl(MnO2)
加水溶解、过滤、洗涤、干燥
B
FeSO4溶液(CuSO4)
加入适量的锌粉,过滤
C
CuSO4(H2SO4)
加入氯化钡溶液、过滤
D
Cu(CuO)
加入稀盐酸溶解、过滤、洗涤、干燥
难度: 困难查看答案及解析
-
小红同学向盐酸与氯化钡的混合溶液中逐滴滴入碳酸钠溶液至过量,记录滴入的碳酸钠溶液的质量(x)与有关量的变化关系如图所示,下列判断正确的是

A. ①图中,当碳酸钠溶液加至a点时,溶液中Na2CO3正与BaCl2发生反应
B. ②图中,当碳酸钠溶液加至b点时,所得溶液的pH=7
C. ③图中,当碳酸钠溶液加至c点时,溶液中含有的溶质是氯化钠和氯化钡
D. ④图中,当碳酸钠溶液加至d点时,溶液中BaCl2与Na2CO3恰好反应完全
难度: 中等查看答案及解析
-
质量为50g溶质质量分数为20%的氢氧化钾溶液和质量为50g溶质质量分数为20%的稀硫酸混合,所得溶液的PH( )
A. 小于7 B. 等于7 C. 大于7 D. 不确定
难度: 简单查看答案及解析
-
有一包白色粉末,可能由MgCl2、NaOH、BaCl2、Na2SO4中的一种或多种组成.取少量该白色粉末于烧杯中,向烧杯中加入足量水搅拌后,观察到有白色不溶物存在;再向烧杯中滴加酸溶液.根据加酸过程中观察到的现象绘制如下列说法合理的是( )
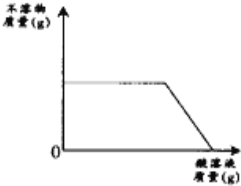
A.加水后得到的液体中可能含有OH-
B.白色不溶物可能为Mg(OH)2或BaSO4
C.原固体中可能含有三种物质
D.酸溶液不可能为稀硫酸
难度: 困难查看答案及解析