-
下列物质按强电解质、弱电解质、酸性氧化物、碱性氧化物的组合中,正确的是( )
强电解质
弱电解质
酸性氧化物
碱性氧化物
A
H2SO4
CH3COOH
NO2
Na2O
B
BaSO4
HClO
Mn2O7
CaO
C
NaCl
氨水
SO2
MnO2
D
HI
HF
CO2
Fe3O4
难度: 中等查看答案及解析
-
化学与环境、材料、信息、能源关系密切,下列说法中不正确的是( )
A.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水
B.“光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关
C.尽量使用含12C的产品,减少使用含13C或14C的产品符合“促进低碳经济”宗旨
D.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
难度: 简单查看答案及解析
-
NA为阿伏伽德罗常数的值.下列说法正确的是( )
A.18gD2O和18gH2O中含有的质子数均为10NA
B.2L0.5mol/L亚硫酸溶液中含有的H+个数为2NA
C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
D.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于ⅠA族,W与X属于同一主族。下列说法正确的是
A. 元素X、W的简单阴离子具有相同的电子层结构
B. 由Y、Z两种元素组成的化合物是离子化合物
C. W的简单气态氢化物的热稳定性比Y的强
D. 原子半径:r(X)<r(Y)<r(Z)<r(W)
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+ HClO
B.向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-
C.NH4HCO3溶液和少量的NaOH溶液混合:HCO
+OH-===CO
+H2O
D.向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I- = 2Fe2++I2
难度: 中等查看答案及解析
-
室温下,将1mol的CuSO4•5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2:CuSO4•5H2O受热分解的化学方程式为CuSO4•5H2O(s)
CuSO4(s)+5H2O(l),热效应为△H3,则下列判断正确的是( )
A.△H2>△H3 B.△H1<△H3 C.△H1+△H3=△H2 D.△H1+△H2>△H3
难度: 中等查看答案及解析
-
下列图示与对应的叙述不相符合的是
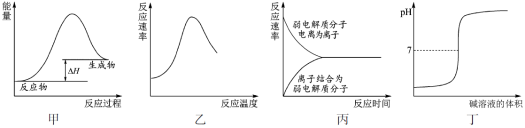
A.图甲表示燃料燃烧反应的能量变化
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示弱电解质在水中建立电离平衡的过程
D.图丁表示强碱滴定强酸的滴定曲线
难度: 中等查看答案及解析
-
下列有关仪器使用方法或实验操作正确的是( )
A. 洗净的锥形瓶和容量瓶可以放进烘箱烘干
B. 用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体
C. 酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差
D. 酸式滴定管装标准溶液前,必须先用标准溶液润洗
难度: 中等查看答案及解析
-
用H2O2溶液处理含NaCN的废水的反应原理为NaCN + H2O2 + H2O = NaHCO3 + NH3 ,已知:HCN的酸性比H2CO3弱。下列有关说法正确的是( )
A.该反应中氮元素被氧化
B.该反应中H2O2作还原剂
C.0.1mol·L-1NaCN溶液中含有HCN和CN-的总数为0.1×6.02×1023
D.实验室配制NaCN溶液时,需加入适量的NaOH溶液
难度: 中等查看答案及解析
-
制备(NH4)2Fe(SO4)2·6H2O的实验中,需对过滤出产品的母液(pH<1)进行处理。室温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是
A.通入过量Cl2:Fe2+、H+、NH4+、Cl–、SO42–
B.加入少量NaClO溶液:NH4+、Fe2+、H+、SO42–、ClO–
C.加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42–、OH–
D.加入过量NaClO和NaOH的混合溶液:Na+、SO42–、Cl–、ClO–、OH–
难度: 困难查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
将稀硫酸和Na2S反应生成的气体通入
AgNO3与AgCl组成的浊液中
Ksp(AgCl)>Ksp(Ag2S)
B
室温下,向浓度均为0.1 mol·L–1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。
Ksp(BaSO4)<Ksp(CaSO4)
C
室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色。
Fe3+的氧化性比I2的强
D
室温下,用pH试纸测得0.1mol·L–1 Na2SO3溶液的pH约为10;0.1mol·L–1 NaHSO3溶液的pH约为5。
HSO3–结合H+的
能力比SO32–的强
难度: 困难查看答案及解析
-
下列化工生产过程中,未涉及氧化还原反应的是
A.海带提碘 B.氯碱工业 C.氨碱法制纯碱 D.海水提溴
难度: 简单查看答案及解析
-
能证明乙酸是弱酸的实验事实是
A.CH3COOH溶液与Zn反应放出H2
B.常温下,0.1 mol/L CH3COONa溶液的pH大于7
C.CH3COOH溶液与Na2CO3反应生成CO2
D.0.1 mol/L CH3COOH溶液可使紫色石蕊变红
难度: 中等查看答案及解析
-
下列说法正确的是
A. 有质子的微粒一定有中子
B. 通常所说的氢元素是指
H
C. 16O中的“16”表示氧元素的近似相对原子质量
D. 根据反应K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O得到的Cl2,其相对分子质量为73.3
难度: 中等查看答案及解析
-
向新制氯水中加入少量下列物质,能增强溶液漂白能力的是
A.碳酸钙粉末 B.稀硫酸 C.氯化钙溶液 D.二氧化硫水溶液
难度: 中等查看答案及解析
-
O2F2可以发生反应H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是
A.氧气是氧化产物
B.O2F2既是氧化剂又是还原剂
C.若生成4.48 L HF,则转移0.8 mol电子
D.还原剂与氧化剂的物质的量之比为1:4
难度: 中等查看答案及解析
-
下列气体的制备和性质实验中,由现象得出的结论错误的是
选项
试剂
试纸或试液
现象
结论
A
浓氨水、生石灰
红色石蕊试纸
变蓝
NH3为碱性气体
B
浓盐酸、浓硫酸
pH试纸
变红
HCl为酸性气体
C
浓盐酸、二氧化锰
淀粉碘化钾试液
变蓝
Cl2具有氧化性
D
亚硫酸钠、硫酸
品红试液
褪色
SO2具有还原性
难度: 中等查看答案及解析
-
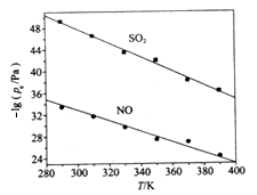
298 K时,在20.0 mL 0.10 mol
氨水中滴入0.10 mol
的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知:在0.10 mol
氨水中有1.32%的NH3·H2O发生电离,下列有关叙述正确的是

A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0 mL
C.M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
难度: 中等查看答案及解析
-
一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS﹣)=1×10﹣5mol•L﹣1
B.pH=a的氨水溶液,稀释10倍后pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH﹣)+c(HC2O4﹣)
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
难度: 中等查看答案及解析
-
类比推理是化学中常用的思维方法。下列推理正确的是
A.Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3
B.SiH4的沸点高于CH4,推测H2S的沸点高于H2O
C.CO2是直线型分子,推测CS2也是直线型分子
D.NaCl与浓H2SO4加热可制HCl,推测NaBr与浓H2SO4加热可制HBr
难度: 中等查看答案及解析
-
一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)
CH3OH(g) 达到平衡。下列说法正确的是
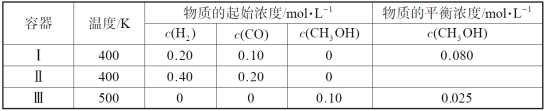
A.该反应的逆反应放热
B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D.达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
难度: 困难查看答案及解析
-
下列有关胶体的说法中,正确的是( )
A.依据丁达尔现象可将分散系分为溶液、胶体与浊液体
B.Fe(OH)3胶体在电场中可作定向移动,是因为Fe(OH)3胶体带电
C.将0.1mol FeCl3滴入沸水中,形成的胶体粒子数目为0.1NA
D.向Fe(OH)3胶体中逐滴滴入2mol/LH2SO4有沉淀生成,继续滴加沉淀溶解
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是
A.向0.1mol
CH3COOH溶液中加入少量水,溶液中
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中
增大
C.向盐酸中加入氨水至中性,溶液中
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中
不变
难度: 中等查看答案及解析
-
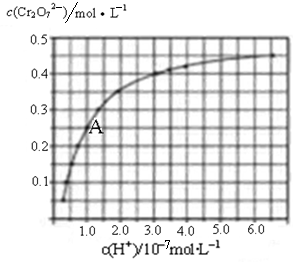
H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4–)+ c(C2O42–)=0.100 mol·L–1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是
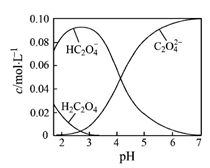
A.pH=2.5的溶液中:c(H2C2O4)+c(C2O42–)>c(HC2O4–)
B.c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH–)+c(C2O42–)
C.c(HC2O4–)=c(C2O42–)的溶液中:c(Na+)>0.100 mol·L–1+c(HC2O4–)
D.pH=7的溶液中:c(Na+)<2c(C2O42–)
难度: 困难查看答案及解析
-
在恒容密闭容器中通入物质的量浓度均0.1mol·L-1的CH4与CO2,在一定条件下发生反应:CO2(g)+CH4(g)
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图5,下列有关说法正确的是( )
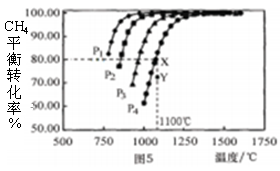
A.上述反应的△H>0 B.压强P1>P2>P3>P4
C.1100℃该反应的平衡常数为64 D.压强为P4时,在Y点:v(正)<v(逆)
难度: 困难查看答案及解析