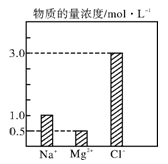
-
下列实验操作中错误的是
A.分液时,分液漏斗下层液体从活塞放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C.蒸发结晶时应将溶液蒸干
D.两种互不相溶,密度也不相同的液体可以用分液漏斗分离,例如苯和水
难度: 简单查看答案及解析
-
能表示阿伏加德罗常数数值的是:
A、1 mol金属钠含有的电子数
B、1 L 1 mol/L硫酸溶液所含的H+数
C、标准状况下,22.4 L四氯化碳所含的分子数
D、0.012 kg 12C所含的原子数
难度: 简单查看答案及解析
-
相等物质的量的H2O和H2O2相比较,下列有关叙述中正确的是
①它们所含的分子数目之比为1∶1;②它们所含的原子总数目之比为3∶4;③它们所含的O原子数目之比为1∶2;④它们所含的H原子数目之比为1∶1;⑤它们所含的质子数目之比为5∶9
A、①②③ B、③④⑤ C、①②④ D、①②③④⑤
难度: 中等查看答案及解析
-
5.4 g M和16.0 g N恰好完全反应,生成0.2 mol X和10.2 g Y,则X的摩尔质量为:
A、56 B、56 g·mol -1 C、28 D、28 g·mol -1
难度: 中等查看答案及解析
-
常温常压下,用等质量的氢气、甲烷、氧气、二氧化碳四种气体分别吹出四个气球,其中气体为甲烷的是
难度: 中等查看答案及解析
-
用53 g Na2CO3固体配成2 L溶液,则Na2CO3的物质的量浓度为:
A、0.25mol·L-1 B、0.50mol·L-1 C、0.75mol·L-1 D、1.25mol·L-1
难度: 中等查看答案及解析
-
下列指定物质的所占有体积约为最大的是:
A、标准状况下56 g 铁原子 B、20℃、101 kPa时36.5g HCl
C、标准状况下6.02×1023 个NH3 D、标准状况下1mol C2H5OH
难度: 中等查看答案及解析
-
下列反应中,不属于氧化还原反应的是:
A、NH4Cl + NaOH
NaCl+ H2O + NH3↑
B、2H2S+O2=2H2O+2S↓
C、NaH+H2O=NaOH+H2↑
D、2KMnO4
K2MnO4 + MnO2 + O2↑
难度: 简单查看答案及解析
-
从元素化合价变化的角度分析,下列反应中,画线的物质发生氧化反应的是:
A、SO2 + 2NaOH = Na2SO3 + H2O
B、2CuO + C
2Cu + CO2↑
C、2FeCl3 + Fe = 3FeCl2
D、MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑
难度: 中等查看答案及解析
-
硫酸钠和氯化钠溶液等体积混合后,钠离子浓度为0.7mol·L-1, 硫酸根离子的浓度为0.2mol·L-1,则混合液中氯离子的浓度为:
A、0.15mol·L-1 B、0.3mol·L-1 C、0.45mol·L-1 D、0.2mol·L-1
难度: 中等查看答案及解析
-
FeCl3溶液、Fe(OH)3胶体、Fe(OH)3浊液是三种重要的分散系,下列叙述中不正确的是:
A、 Fe(OH)3胶体区别于其他分散系的本质特征是分散质粒子的直径在10-9~10-7米之间
B、分别用一束光透过三种分散系,只有Fe(OH)3胶体具有丁达尔效应
C、三种分散系的颜色都相同,且均能与盐酸反应,具有吸附性
D、三种分散系中分散质均属于电解质
难度: 中等查看答案及解析
-
赤铜矿的主要成分是氧化亚铜(Cu2O),辉铜矿的主要成分是硫化亚铜(Cu2S),将赤铜矿与辉铜矿混合加热有如下反应:Cu2S+2Cu2O=6Cu+SO2↑,下列对于该反应的说法正确的是
A.该反应中的氧化剂只有Cu2O
B.Cu既是氧化产物又是还原产物
C.Cu2S在反应中既是氧化剂又是还原剂
D.氧化产物与还原产物的物质的量之比为6:1
难度: 中等查看答案及解析
-
下列离子检验的方法正确的是
A.某溶液
有白色沉淀,说明原溶液中有Cl-
B.某溶液
有白色沉淀,说明原溶液中有SO42-
C.某溶液
有蓝色沉淀,说明原溶液中有Cu2+
D.某溶液
生成无色气体,说明原溶液中有CO32-
难度: 中等查看答案及解析
-
下列各组物质按纯净物、混合物、电解质、非电解质的顺序排列的是:
A、纯碱、氯水、氢氧化钠、干冰 B、醋酸、盐酸、铜、氨气
C、石灰石、石油、水、硫酸钡 D、烧碱、海水、氯化钠、氯气
难度: 中等查看答案及解析
-
某同学想要从碘的饱和水溶液中萃取碘,关于该实验的说法中不正确的是:
A、使用分液漏斗前应先检查其是否漏液
B、可以选用苯、汽油、酒精和四氯化碳为萃取剂
C、若用四氯化碳为萃取剂,将两种液体混合,充分振荡,静置,分层后,下层液体呈紫红色
D、分层后,打开分液漏斗活塞,使全部下层液体沿承接液体的烧杯内壁流出,然后上层液体从漏斗上口倒出
难度: 中等查看答案及解析
-
在一个恒容密闭容器中盛有22g气体X (X的摩尔质量为44g·mol-1),容器内压强2×104Pa。若在相同温度下继续把气体X充入容器,使容器内压强增大到5×104Pa,则这时容器内气体X的分子数约为:(注:恒温恒容下,气体的压强之比等于气体的分子数之比)
A、3.3×1023 B、3.3×1024 C、7.5×1023 D、7.5×1022
难度: 中等查看答案及解析
-
在标准状况下,一个充满Cl2的恒容密闭容器的质量为74.6 g,若改充满N2,其质量为66 g,则容器的容积为:
A.5.6L B.11.2L C.2.24L D.4.48L
难度: 中等查看答案及解析