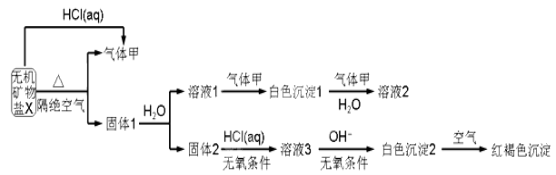
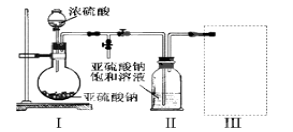
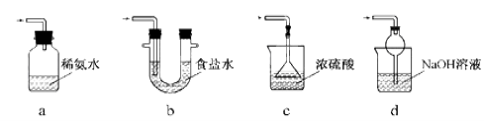
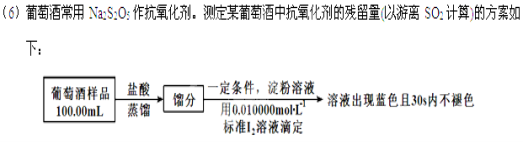
-
某物质熔融状态可导电,固态可导电,将其投入水中溶液也可导电,推测该物质可能是
A.金属 B.非金属 C、可溶性碱 D、可溶性盐
难度: 中等查看答案及解析
-
下列物质的使用不涉及化学变化的是
A.明矾用作净水剂 B.液氨用作制冷剂 C.氢氟酸刻蚀玻璃 D.生石灰作干燥剂
难度: 中等查看答案及解析
-
下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是
A.盐酸、天然气、醋酸、干冰 B.胆矾、漂白粉、氯化钾、氯气
C.氯化钠、福尔马林、硫酸钠、乙醇 D.单甘油酯、混甘油酯、苛性钾、石灰
难度: 中等查看答案及解析
-
下列关于胶体的说法不正确的是
A.可用渗析法提纯胶体
B.胶体、溶液和浊液这三种分散系的根本区别是分散质粒子直径的大小
C.胶体微粒不能透过滤纸
D.往25mL沸水中逐滴加入2mLFeCl3饱和溶液,继续煮沸可制得Fe(OH)3胶体
难度: 简单查看答案及解析
-
水溶液中能大量共存的一组离子是
A.Na+、Ca2+、Cl-、SO42- B.Fe2+、H+ 、SO32-、ClO-
C.Mg2+、NH4+、Cl- 、SO42- D.K+、Fe3+、NO3-、SCN-
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.Cu溶于稀硝酸HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O
B.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓
C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D.向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH) 3↓+HCO3-
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
B.0.1mol丙烯酸中含有双键的数目为0.1NA
C.标准状况下,11.2L苯中含有分子的数目为0.5NA
D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA
难度: 困难查看答案及解析
-
设NA为阿伏伽德罗常数的数值。下列说法正确的是
A.1mol甲苯含有6NA个C-H键
B.18gH2O含有10NA个质子
C.标准状况下,22.4L氨水含有NA个NH3分子
D.56g铁片投入足量浓硫酸中生成NA个SO2分子
难度: 中等查看答案及解析
-
下列关于物质分类的说法正确的是
A.金刚石、白磷都属于单质 B.漂白粉、石英都属于纯净物
C.氯化铵、次氯酸都属于强电解质 D.葡萄糖、蛋白质都属于高分子化合物
难度: 简单查看答案及解析
-
同位素示踪法可用于反应机理的研究,下列反应中同位素示踪表示正确的是
A.2Na218O2 + 2H2O = 4Na18OH + O2↑
B.2KMnO4 + 5H218O2 + 3H2SO4 = K2SO4 + 2MnSO4 + 518O2↑ + 8H2O
C.NH3· 2H2O + HCl =NH4Cl + 2H2O
D.K37ClO3 + 6HCl = K37Cl + 3Cl2 ↑+ 3H2O
难度: 中等查看答案及解析
-
向某烧碱溶液中通入5.28gCO2后,将溶液在低温下蒸干,得到固体物质的质量为17.32g,则该固体物质是
A .Na2CO3 B.NaHCO3 C.Na2CO3和NaOH D.Na2CO3和NaHCO3
难度: 中等查看答案及解析
-
下列各组离子,能在指定溶液中共存的是
①无色溶液中:K+、Cl-、Na+、HCO3-、OH-
② 使pH试纸变深蓝色的溶液中: K+、CO32-、Na+、AlO2-
③水电离的c(H+)=10-12mol·L-1的溶液中:ClO-、HCO3-、NO3-、NH4+、SO32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、Na+、SO42-
⑤使甲基橙变红的溶液中:MnO4-、NO3-、SO42-、Na+、Fe3+
⑥pH=0的溶液中:Fe2+、Al3+、NO3-、Cl-、SO32-
①③ B.②④⑤ C.①②⑤ D.③⑥
难度: 中等查看答案及解析
-
将标准状况下的a LHCl(气)溶于1000 g水中得到的盐酸密度为
,则该盐酸的物质的量的浓度是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
如图所示,6个编号分别表示六种物质:Al、Fe2O3、NaOH溶液、氢碘酸、NH3、O2。凡是直线相连的两种物质均能发生化学反应(已知高温时氨气能还原Fe2O3。)图中⑤表示的物质是
A.Al或Fe2O3 B.NaOH溶液
C.氢碘酸 D.NH3或O2
难度: 中等查看答案及解析
-
已知M2On2- 离子可与R2- 离子作用,R2- 被氧化为R单质,M2On2-的还原产物中,M为+3价;又如c(M2On2 )=0.3 mol•L 的溶液100 mL可与c(R2- )=0.6 mol•L 的溶液150 mL恰好完全反应,则n值为
A.4 B.5 C.6 D.7
难度: 中等查看答案及解析
-
某无色气体,可能含HCl、CO2 、NO2 、HI、SO2 、HBr的一种或几种。将其通人氯水中,得到无色透明溶液,把溶液分成两份,向一份中加入盐酸酸化的BaCl2溶液,出 现白色沉淀,另一份加入硝酸酸化的AgNO3溶液,也有白色沉淀生成。对于原无色气体推断一定正确的是
A.一定存在HCl B.一定存在SO2
C.肯定没有CO2 D.不能肯定是否含有NO2、HI
难度: 中等查看答案及解析
-
在FeCl3,CuCl2,FeCl2的混合溶液中,Fe3+,Cu2+和Fe2+的物质的量之比为3∶2∶1,现加入适量铁粉,使溶液中三种离子物质的量浓度之比变化为1∶2∶4,则参加反应的铁粉与原溶液Fe3+的物质的量之比为
A.2∶1 B.1∶2 C.1∶3 D.1∶4
难度: 中等查看答案及解析
-
氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C
2AlN+3CO合成。下列叙述正确的是
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1molAlN需转移3mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41g
难度: 中等查看答案及解析
-
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4
2ClO2↑+2CO2↑+K2SO4+2H2O。下列说法正确的是
A.H2SO4是氧化剂 B.ClO2是氧化产物
C.H2C2O4在反应中被氧化 D.1 molKClO3参加反应有2mol电子转移
难度: 中等查看答案及解析
-
已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;
②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是
A.上述实验证明氧化性:MnO4->Cl2>Fe3+>I2
B.上述实验中,共有两个氧化还原反应
C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
难度: 中等查看答案及解析
-
某无色溶液中只可能含有NH4+、K+、Al3+、Mg2+、Fe3+、Cl-、CO32-、SO42--等离子中的几种离子。①取10mL该溶液于试管中滴加Ba(NO3)2溶液并加稀硝酸酸化后过滤得到0.03mol白色沉淀,向滤液中加入AgNO3溶液未见沉淀产生。
②另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀,沉淀的量与所加氢氧化钠溶液体积如下图所示
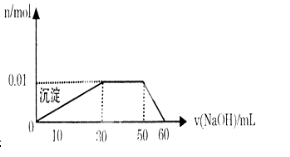
(1)该溶液中一定含有______________离子,一定不含有的离子有___________________(填离子的化学式);
(2)根据图中所示数据,计算实验中使用的NaOH溶液的物质的量浓度为:______________
(3)若取10mL该溶液于试管中,向其中加入适量Na2O2,若恰好反应得到无色溶液,则该过程所得气体在标况下体积为___________L
难度: 困难查看答案及解析