-
不能用浓硫酸干燥的气体是( )
A.NH3 B.SO2 C.Cl2 D.HCl
难度: 简单查看答案及解析
-
金属性最强的元素是( )
A. Li B. Na C. Mg D. K
难度: 简单查看答案及解析
-
属于电解质的是( )
A. 盐酸 B. 食盐 C. 液氯 D. 酒精
难度: 简单查看答案及解析
-
醋酸钠中不存在( )
A. 离子键 B. 极性键 C. 非极性键 D. 分子间作用力
难度: 简单查看答案及解析
-
硫酸铜晶体中结晶水含量测定,需用的仪器有( )
A. 容量瓶 B. 分液漏斗 C. 干燥器 D. 滴定管
难度: 简单查看答案及解析
-
不能通过化合反应得到的是( )
A. NH4Cl B. Cu2S C. FeCl2 D. Al(OH)3
难度: 简单查看答案及解析
-
下列电离方程式错误的是( )
A. HCl→H++Cl- B. H2CO3
2H++CO32-
C. NaCl→Na++Cl- D. NH3·H2O
NH4++OH-
难度: 简单查看答案及解析
-
能用离子方程式 H++ OH-→ H2O 表示的反应是( )
A. 氨水和盐酸 B. 氢氧化钠溶液和醋酸
C. 硫酸和氢氧化钡溶液 D. 硝酸和石灰水
难度: 中等查看答案及解析
-
将后者逐渐滴入(或通入)前者至过量,有沉淀产生且最终消失的是( )
A. 氯化铝、氨水 B. 氢硫酸、氧气
C. 硫酸铝、氢氧化钠 D. 氯化亚铁、氯气
难度: 中等查看答案及解析
-
氮原子 2p 亚层上的 3 个电子不相同的是( )
A. 能量 B. 电子云形状
C. 电子云伸展方向 D. 自旋状态
难度: 简单查看答案及解析
-
有机物命名正确的是( )
A. 1,3-二甲基丁烷 B. 2,3,5-三甲基己烷
C. 2,3-二甲基-2-乙基己烷 D. 2,3-二甲基-4-乙基戊烷
难度: 中等查看答案及解析
-
下列比较或归纳一定正确的是( )
A. 离子半径:阴离子>阳离子 B. 酸性:HClO4>H2SO4
C. 熔沸点:共价化合物>离子化合物 D. 稳定性:PH3>NH3
难度: 中等查看答案及解析
-
漂粉精久置空气中会变质,在变质过程中不会涉及的性质是( )
A. H2CO3 的酸性 B. HClO 的不稳定性
C. HClO 的弱酸性 D. HClO 的漂白性
难度: 中等查看答案及解析
-
下列醇不能由烃和水加成制得的是( )
A.
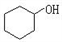 B.
B.  C.
C. 
难度: 中等查看答案及解析
-
实验室制备乙酸丁酯的叙述正确的是( )
A. 采用水浴加热法控制温度
B. 采用边反应边蒸馏的方法提高产率
C. 制取装置中有冷凝回流措施
D. 用水和氢氧化钠溶液洗涤后分液分离出产品
难度: 中等查看答案及解析
-
所示装置目的不能达到的是( )

A.吸收多余氨气
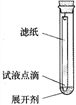
B.Fe3+、Cu2+的分离

C.酒精和浓硫酸制取乙烯

D.充分利用反应中的能量
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2 均为正值):
H2(g)+Cl2(g)→2HCl(g)+Q1kJ H2(g)+Br2(g)→2HBr(g)+Q2kJ 根据上述反应做出的判断不正确的是( )
A. Q1>Q2
B. 生成物总能量均低于反应物总能量
C. 生成 2mol HCl(g)放出 Q1kJ 热量
D. 若反应生成 2mol 液态溴化氢,放出的热量低于 Q2kJ
难度: 中等查看答案及解析
-
相同温度时 100mL 0.01mol/L 的碳酸钠溶液与 10mL 0.1mol/L 的碳酸钠溶液相比,下列数值前者大于后者的是( )
A. OH-的物质的量 B. CO32-的物质的量
C. c(HCO3-) D. 由水电离的 c(OH-)
难度: 中等查看答案及解析
-
右图所示电化学装置(电极都是惰性电极)的判断合理的是( )

A. 若 Z 为饱和食盐水,则 X 是阴极
B. 若 Z 为饱和食盐水,则碱在 X 附近生成
C. 若 Z 为氯化铜溶液,Y 附近能得到氯气
D. 若 Z 为氯化铜溶液,X 附近发生氧化反应
难度: 中等查看答案及解析
-
在铁的氧化物和氧化铝组成的混合物中,加入 2 mol/L 硫酸溶液 65 mL,恰好完全反应,所得溶液中Fe2+能被标准状况下 112 mL 氯气氧化。则原混合物中金属元素和氧元素的原子个数之比为( )
A. 9∶13 B. 5∶7 C. 4∶3 D. 3∶4
难度: 困难查看答案及解析



 结构的 C 的一种同分异构体的结构简式___________________。
结构的 C 的一种同分异构体的结构简式___________________。 )的合成路线。_________
)的合成路线。_________ )
)