-
下列关于甲烷的说法正确的是
A.能使溴的四氯化碳溶液褪色 B.是天然气的主要成分
C.不能发生燃烧反应 D.能发生加成反应
难度: 简单查看答案及解析
-
向沸水中滴加几滴饱和氯化铁溶液并继续煮沸至溶液呈红褐色时停止加热,此时当光束通过该红褐色液体时,从侧面可观察到一条光亮的“通路”说明该红褐色液体是
A.溶液 B.胶体 C.悬浊液 D.乳浊液
难度: 简单查看答案及解析
-
我国宣布到2030年非化石能源占一次能源消费比重将提高到20%左右。下列不属于化石能源的是
A.煤 B.石油 C.天然气 D.生物质能
难度: 简单查看答案及解析
-
尿素[CO(NH2)2]可用于电解制氢气,尿素属于
A.酸 B.碱 C.盐 D.有机物
难度: 简单查看答案及解析
-
下列过程只涉及物理变化的是
A.伐薪烧炭 B.酿酒成醋 C.滴水成冰 D.百炼成钢
难度: 简单查看答案及解析
-
I可用于治疗甲亢,有关
I的说法正确的是
A.中子数为131 B.质子数为131
C.质量数53 D.电子数53
难度: 简单查看答案及解析
-
实验室由海水获得淡水的实验装置是
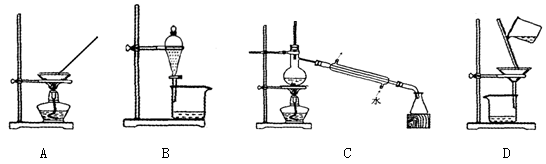
难度: 简单查看答案及解析
-
通入水中所得溶液呈碱性的气体是
A.NH3 B.NO2 C.SO2 D.HCl
难度: 简单查看答案及解析
-
下列物质中,属于电解质的是
A.氯化钠 B.金属铜 C.氢氧化钠溶液 D.蔗糖
难度: 简单查看答案及解析
-
反应2SO2+O2
2SO3在密闭容器中进行。下列关于该反应的说法错误的是
A.升高温度能加快反应速率
B.使用恰当的催化剂能加快反应速率
C.增大O2的浓度能加快反应速率
D.SO2与O2能100%转化为SO3
难度: 中等查看答案及解析
-
某溶液中存在大量的H+、Clˉ、SO42ˉ,该溶液中还可能大量存在的是
A.OH ˉ B.Ba2+ C.Fe3+ D.CO32ˉ
难度: 中等查看答案及解析
-
下列关于化学用语叙述正确的是
A.H2O2的电子式:
B.乙醇的结构式:C2H6O
C.磷原子的结构示意图:
D.FeSO4 的电离方程式:FeSO4=Fe3+ + SO42ˉ
难度: 简单查看答案及解析
-
下列过程吸收热量的是
A.汽油燃烧 B.氨气液化 C.碳酸钙分解 D.浓硫酸稀释
难度: 简单查看答案及解析
-
实验室制备硅酸的反应为Na2SiO3+2HCl=2NaCl+H2SiO3↓,该反应属于
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
难度: 简单查看答案及解析
-
下列有机反应属于加聚反应的是

难度: 中等查看答案及解析
-
下列有关物质用途的说法正确的是
A.明矾可用作净水剂 B.甲醛可用作食品防腐剂
C.氢氧化钠可用来治疗胃酸过多 D.铝制容器可长期存放酸性食物
难度: 简单查看答案及解析
-
用NA表示阿伏伽德罗常数的值。下列判断正确的是
A.28g N2含有的氮原子数目为NA
B.常温常压下,22.4L Cl2含有的分子数目为NA
C.1molNa变为Na+时失去的电子数目为NA
D.1L 1mol·L—1K2CO3溶液中含有的钾离子数目为NA
难度: 中等查看答案及解析
-
钛合金被誉为二十一世纪的金属,具有广泛的用途。金属钛可用下列方法提炼:
① TiO2+2C+2Cl2
TiCl4+2CO
② TiCl4+2Mg
2MgCl2+Ti
对上述两个反应,下列有关叙述正确的是
A.反应①中碳元素被还原 B.反应②中钛元素被氧化
C.反应①中Cl2是还原剂 D.反应②中TiCl4是氧化剂
难度: 中等查看答案及解析
-
下列关于Cl2性质的说法正确的是
A.密度比空气小 B.是无色无味的气体
C.能使干燥的有色布条褪色 D.可与NaOH溶液反应
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是
A.氯气与氢氧化钠溶液反应:Cl2 + 2OH-=Cl-+ ClO-+ H2O
B.碳酸钙与稀醋酸反应:CO32-+ 2CH3COOH =2CH3COO-+ H2O + CO2↑
C.铁粉与稀盐酸反应:2Fe + 6H+=2Fe3+ + 3H2↑
D.铜片与氯化铁溶液反应 Cu + Fe3+ =Cu2+ + Fe2+
难度: 中等查看答案及解析
-
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。下列叙述正确的是
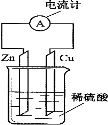
A.电流从铜片经导线流向锌片
B.该装置将电能转变为化学能
C.一段时间后,铜片质量减轻
D.锌片发生还原反应
难度: 中等查看答案及解析
-
A、B、C、D为短周期元素,且原子序数依次增大。已知A原子的最外层电子数是其电子层数的2倍,B是地壳中含量最高的元素,B原子的最外层电子数是D原子最外层电子数的2倍,C原子最外层只有一个电子。下列说法正确的是
A.非金属性:A>B
B.四种元素中,C处于元素周期表中最左、下方,故原子半径最大
C.元素B和C只能形成一种化合物
D.A、C、D的最高价氧化物对应的水化物中没有两性氢氧化物
难度: 中等查看答案及解析
-
某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1)200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12 L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
A.一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+
B.一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+
C.c(CO32-)=0.01 mol·L-1,c(NH4+)>c(SO42-)
D.如果上述6种离子都存在,则c(Cl-)>c(SO42-)
难度: 困难查看答案及解析