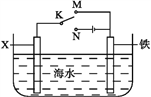
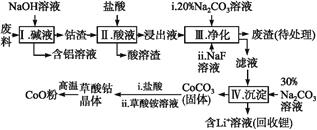
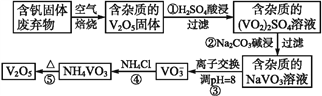
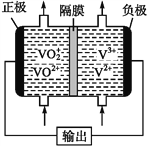
-
化学在生活中有着广泛的应用,下列对应关系错误的是( )
化学性质
实际应用
A.
Al2(SO4)3和小苏打反应
泡沫灭火器灭火
B.
铁比铜金属性强
FeCl3腐蚀Cu刻制印刷电路板
C.
次氯酸盐具有氧化性
漂白粉漂白织物
D.
HF与SiO2反应
氢氟酸在玻璃器皿上刻蚀标记
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A.AlCl3溶液中通入过量的氨水:Al3++4NH3·H2O=AlO2-+2H2O+4NH4+
B.向NH4 HCO3溶液中加过量NaOH 溶液并加热:NH4++OH-
NH3↑+H2O
C.将Cu片加入稀硝酸中:3Cu+8H++2NO3- =3Cu2++2NO↑+4H2O
D.向Na2S2O3溶液中加入稀硫酸:2S2O32—+2H+=SO42—+3S↓+H2O
难度: 中等查看答案及解析
-
下列图中的实验方案,能达到实验目的的是( )
实验方案
实验目的
A
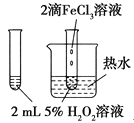
验证FeCl3对H2O2分解反应有催化作用
B
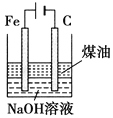
制备Fe(OH)2并能较长时间观察其颜色
C
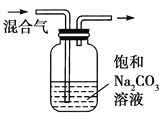
除去CO2气体中混有的SO2
D
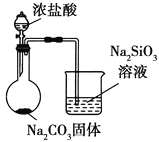
比较HCl、H2CO3和H2SiO3的酸性强弱
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的值,下列有关叙述正确的是
A.电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA
B.标准状况下,44.8LNO与22.4LO2混合后气体中分子总数等于2NA
C.NO2和H2O反应每生成2molHNO3时转移的电子数目为2NA
D.lmolFe在氧气中充分燃烧失去3NA个电子
难度: 中等查看答案及解析
-
K2Cr2O7溶液中存在平衡: Cr2O72-(橙色)+H2O
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
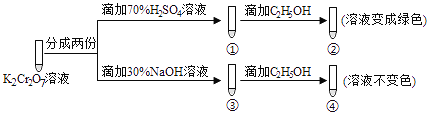
A. ①中溶液橙色加深,③中溶液变黄
B. ②中Cr2O72-被C2H5OH还原
C. 对比②和④可知K2Cr2O7酸性溶液氧化性强
D. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
难度: 困难查看答案及解析
-
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13,X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍,下列说法正确的是
A. X的氢化物溶于水生成弱酸
B. Z的氢化物的水溶液在空气中存放不易变质
C. Y与X可生成Y3X2型化合物
D. Z的单质在氧气中燃烧可以生成两种酸性氧化物
难度: 中等查看答案及解析
-
锌–空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O===2Zn(OH)42-。下列说法正确的是( )
A. 充电时,电解质溶液中K+向阳极移动
B. 充电时,电解质溶液中c(OH-) 逐渐减小
C. 放电时,负极反应为:Zn+4OH–-2e–= Zn(OH)42-
D. 放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
难度: 中等查看答案及解析