-
在四个不同的容器中,分别进行不同条件下的合成氨反应N2(g)+3H2(g)
2NH3(g)。在相同时间内表示该反应速率最快的是
A.v(H2)=0.1 mol/(L·s) B.v(N2)=0.1 mol/(L·s)
C.v(N2)=0.2 mol/(L·s) D.v(NH3)=0.3 mol/(L·s)
难度: 中等查看答案及解析
-
根据下列热化学方程式
(1)C(s)+O2(g)=CO2(g) △H1=-393.5 kJ/mol
(2)H2(g)+
O2(g)=H2O(1) △H2=-285.8 kJ/mol
(3)CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1) △H3=-870.3 kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)=CH3COOH(1)的△H为
A.△H=+244.1kJ/mol B.△H=-488.3 kJ/mol
C.△H=-996.6 kJ/mol D.△H=+996.6 kJ/mol
难度: 中等查看答案及解析
-
下列有关平衡常数说法正确的是
A.温度越高,K值越大
B.K值越大,反应的转化率越小
C.K值越大,反应的转化率越大
D.K值的大小与起始浓度有关
难度: 中等查看答案及解析
-
下列化学方程式中,属于水解反应的是
A.HCOOH+H2O
HCOO-+H3O+ B.HS-+H2O
S2-+H3O+
C.CO2+H2O
HCO3-+H+ D.CO32-+H2O
HCO3-+OH-
难度: 中等查看答案及解析
-
在pH=1的无色溶液中能大量共存的离子组是
A.NH4+、Mg2+、SO42-、Cl- B.Ba2+、K+、OH-、NO3-
C.Al3+、Cu2+、SO42-、Cl- D.Na+、Ca2+、Cl-、AlO2-
难度: 中等查看答案及解析
-
25oC时,amol·L-1一元酸HA溶液与b mol·L-1 NaOH溶液等体积混合后,pH为7,则下列关系一定正确的是
A.a=b B.a>b C.c(A-)=c(Na+) D.c(A-)<c(Na+)
难度: 中等查看答案及解析
-
水中加入下列溶液对水的电离平衡不产生影响的是
A.NaHSO4溶液 B.KF溶液 C.KAl(SO4)2溶液 D.NaI溶液
难度: 中等查看答案及解析
-
常温下0.1 mol·L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是
A.将溶液稀释到原来体积的10倍 B.加入适量的醋酸钠固体
C.提高溶液的温度 D.加入等体积0.2 mol·L-1盐酸
难度: 中等查看答案及解析
-
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)
2CO2(g)+S(l) △H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应的平衡常数不变
难度: 中等查看答案及解析
-
结合下图判断,下列叙述正确的是
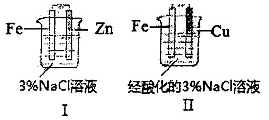
A.I和Ⅱ中正极均被保护
B.I和Ⅱ中负极反应均是Fe-2e-=Fe2+
C.I和Ⅱ中正极反应均是O2+2H2O+4e-=4OH-
D.I和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀
难度: 中等查看答案及解析
-
相同体积的pH=3的强酸溶液和弱酸溶液分别跟足量的镁完全反应说法正确的,下列是
A.弱酸溶液产生较多的氢气
B.强酸溶液产生较多的氢气
C.两者产生等量的氢气
D.无法比较两者产生氢气的量
难度: 中等查看答案及解析
-
0.1 mol·L-1NaOH溶液和0.1 mol·L-1NH4C1溶液等体积混合,离子浓度大小正确的是
A.c(Na+)>c(C1-)>c(OH-)>c(H+)
B.c(Na+)=c(C1-)>c(OH-)>c(H+)
C.c(Na+)=c(C1-)>c(H+)>c(OH-)
D.c(C1-)>c(Na+)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
下列实验误差分析错误的是
A.用润湿的pH试纸测稀碱溶液的pH,测定值偏小
B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度差值偏小
难度: 中等查看答案及解析
-
实验①0.1 mol·L-1AgNO3溶液和0.1 mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀C;②向滤液b中滴加0.1 mol·L-1KI溶液,出现浑浊;③向沉淀C中滴加0.1 mol·L-1KI溶液,沉淀变为黄色。
下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s)
Ag+(aq)+C1-(aq)
B.滤液b中不含Ag+
C.③中颜色变化说明AgCl转化为AgI
D.实验可以证明AgI比AgCl更难溶
难度: 中等查看答案及解析
-
下列电解质溶液的有关叙述正确的是
A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7
B.在含有BaSO4沉淀的溶液中加入K2SO4固体,c(Ba2+)增大
C.含l mol KOH的溶液与l mol CO2完全反应后,溶液中c(K+)>c(HCO3-)
D.在(NH4)2SO4溶液中加入适量H2SO4,可使c(NH4+)=2c(SO42-)
难度: 中等查看答案及解析
-
在密闭容器中进行如下反应:H2(g)+I2(g)
2HI(g),在温度T1和T2时,产物的量与反应时间的关系如下图所示,符合图示的正确判断是
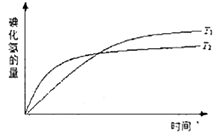
A.T1>T2,△H>0 B.T1> T2,△H<0
C.T1 <T2,△H>0 D.T1 < T2,△H<0
难度: 中等查看答案及解析
-
在一定体积的密闭容器中放入3 L气体R和5 L气体Q,在一定条件下发生反应:2R(g)+5Q(g)
4X(g)+nY(g)。反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中的n值是
A.2 B.3 C.4 D.5
难度: 中等查看答案及解析
-
已知温度T时,水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA溶液与b mol·L-1的一元碱BOH溶液等体积混合,可判定该溶液呈中性的依据是
A.a=b
B.混合溶液的pH=7
C.混合溶液中,c(H+)=
mol·L-1
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
难度: 中等查看答案及解析
-
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)
MgO(s)+CO2(g)+SO2(g) △H>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后;纵坐标y随x变化趋势合理的是
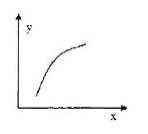
选项 x y
A 温度 容器内混合气体的密度
B CO的物质的量 CO2与CO的物质的量之比
C SO2的浓度 平衡常数K
D MgSO4的质量(忽略体积) CO的转化率
难度: 中等查看答案及解析