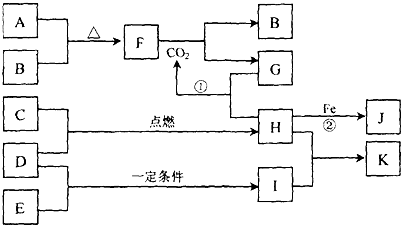
-
某原子核外共有n个电子层(n>3),则(n-1)层最多容纳的电子数为( )
A.8个
B.18个
C.32个
D.无法确定难度: 中等查看答案及解析
-
三种元素X、Y、Z的原子,最外层电子数之和为17,核内质子数之和为31,则这三种元素是( )
A.N、P、Cl
B.P、O、S
C.N、O、S
D.O、F、Cl难度: 中等查看答案及解析
-
不同的化学反应有不同的反应速率,决定化学反应速率的主要因素是( )
A.温度
B.浓度
C.催化剂
D.反应物的性质难度: 中等查看答案及解析
-
X、Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素阳离子半径;Z和Y两元素的原子最外层电子数相同,Z元素的原子半径大于Y元素的原子半径,X、Y、Z三种元素原子序数的关系是( )
A.X>Y>Z
B.Y>X>Z
C.Z>X>Y
D.Z>Y>X难度: 中等查看答案及解析
-
可逆反应N2+3H2⇌2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示.下列关系中能说明反应已达到平衡状态的是( )
A.3v正(N2)=v正(H2)
B.v正(N2)=v正(NH3)
C.v正(H2)=3v逆(NH3)
D.3v正(N2)=v逆(H2)难度: 中等查看答案及解析
-
下列物质不能使溴水退色的是( )
A.乙烯
B.二氧化硫
C.丁烯
D.丙烷难度: 中等查看答案及解析
-
下列措施一定能使反应速率加快的是( )
A.增加反应物的物质的量
B.升高温度
C.缩小容器体积
D.加入生成物难度: 中等查看答案及解析
-
某学生用优质大理石与稀盐酸反应制取CO2,实验结果如下图所示,对于图中曲线的叙述正确的是( )
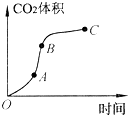
A.AB段表示反应速率最快
B.BC段表示反应速率最快,在该时间内收集到的气体最多
C.OC段表示随时间增加,反应速率逐渐增大
D.OC段表示反应产物中气体体积随时间的变化关系难度: 中等查看答案及解析
-
对于在密闭容器中、一定条件下进行的可逆反应N2(g)+3H2(g)
2NH3(g),能说明反应已达到平衡状态的是( )
A.各物质体积分数相等
B.c(NH3)保持不变
C.各物质浓度相等
D.c(NH3):c(N2):c(H2)=2:1:3难度: 中等查看答案及解析
-
对原电池的电极名称,下列叙述中错误的是( )
A.电子流入的一极为正极
B.比较不活泼的一极为正极
C.电子流出的一极为负极
D.发生氧化反应的一极为正极难度: 中等查看答案及解析
-
下列关于能源和作为能源使用的物质的叙述中错误的是( )
A.化石燃料物质内部储存着能量
B.太阳能不能直接转化为化学能
C.物质的化学能可能在不同条件下转化为热能、电能为人类所用
D.绿色植物发生光合作用时,将太阳能转化为化学能储存起来难度: 中等查看答案及解析
-
下列物质属于纯净物的是( )
A.石油
B.汽油
C.柴油
D.乙烯难度: 中等查看答案及解析
-
HF、H2O、CH4、SiH4四种气态氢化物按稳定性由弱到强排列正确的是( )
A.CH4<H2O<HF<SiH4
B.SiH4<HF<CH4<H2O
C.SiH4<CH4<H2O<HF
D.H2O<CH4<HF<SiH4难度: 中等查看答案及解析
-
A、B、C均为短周期元素,它们在周期表中的位置如右图.已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C 所在的一组是( )
A.Be、Na、Al
B.B、Mg、Si
C.O、P、Cl
D.C、Al、P难度: 中等查看答案及解析
-
下列电子式中错误的是( )
A.Na+
B.
C.
D.
难度: 中等查看答案及解析
-
下列各项中表达正确的是( )
A.F-的结构示意图:
B.CO2的分子模型示意图: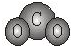
C.NaCl的电子式:
D.N2的结构式::N≡N:难度: 中等查看答案及解析
-
下图各装置中,不能形成原电池的是(烧杯中所盛液体都是稀硫酸)( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
光照混合在试管中的甲烷和氯气的混合气体后,拔开试管塞,在实验的过程中不可能观察到的现象是( )
A.试管中气体的黄绿色变浅
B.试管中有火星出现
C.试管壁上有油状液滴出现
D.试管口有白雾难度: 中等查看答案及解析
-
下列物质之间的反应,属于取代反应的是( )
A.甲烷和氧气
B.甲烷和氯气
C.金属钠和水
D.碘化钾和氯水难度: 中等查看答案及解析
-
在一定条件下,可与苯发生反应的是( )
A.酸性高锰酸钾溶液
B.溴水
C.纯溴
D.氯化氢难度: 中等查看答案及解析
-
1mol甲烷和1mol氯气在光照条件下发生反应,产物中物质的量最多的是( )
A.CH3Cl
B.HCl
C.CH2Cl2
D.CHCl3难度: 中等查看答案及解析
-
在一定条件下,能与甲烷发生反应的是( )
A.浓硫酸
B.氢氧化钠溶液
C.溴蒸汽
D.高锰酸钾溶液难度: 中等查看答案及解析