-
下列叙述正确的是
A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成
B.向Na2 CO3溶液中逐滴加入含等物质的量HCl的稀盐酸,生成的CO2与原Na2 CO3的物质的量之比为1:2
C.等质量的Na HCO3和Na2 CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D.向Na2 CO3饱和溶液中通入CO2,有Na HCO3结晶析出
难度: 简单查看答案及解析
-
为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是
①Na2O2中阴、阳离子的个数比是1:1
②Na2O2分别与水及CO2反应产生等量氧气时,需水和CO2的质量相等
③Na2O2分别与水及CO2反应产等量氧气时,转移电子的物质的量相等
④Na2O2的漂白原理与SO2的漂白原理相同
⑤Na2O2与SO2反应生成Na2SO3与H2O
⑥Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
⑦Na2O2与水反应,Na2O2既是氧化剂,又是还原剂
⑧Na2O2投入到紫色石蕊试液中,溶液先变蓝,后褪色
A.①③⑥⑧ B.③⑦⑧ C.②⑤⑥⑦ D.①④⑧
难度: 简单查看答案及解析
-
下列各组物质,不能按
(“→”表示反应一步完成)关系转化的是
选项
a
b
c
A
Al2O3
NaAlO2
Al(OH)3
B
AlCl3
Al(OH)3
NaAlO2
C
Al
Al(OH)3
Al2O3
D
MgCl2
Mg(OH)2
MgO
难度: 简单查看答案及解析
-
某有机化合物的结构简式为:
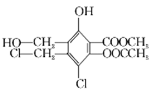 ,下列有关该物质的叙述正确的是
,下列有关该物质的叙述正确的是A.1 mol该物质最多可以消耗3 mol Na
B.1 mol该物质最多可以消耗7 mol NaOH
C.不能与Na2CO3溶液反应
D.易溶于水,可以发生加成反应和取代反应
难度: 中等查看答案及解析
-
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中,属干这种情况的是
①过量锌与18 mol/L的硫酸反应;
②过量氢气与少量氮气在催化剂存在下充分反应;
③浓盐酸与过量的MnO2反应;
④过量铜与浓硫酸反应;
⑤过量稀硝酸与银反应;
⑥过量稀硫酸与大块状石灰石反应。
A.②③④⑥ B.②③⑤ C.①④⑤ D.①②③④⑤⑥
难度: 简单查看答案及解析
-
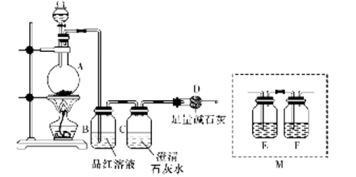
用图中所示的装置进行实验,实验现象与预测不一致的是
①中的物质
②中的物质
预测现象
A
浓氨水
FeCl3溶液
②中有红褐色沉淀
B
浓氨水
浓盐酸
③中有白烟
C
浓硝酸
淀粉KI溶液
②中溶液为蓝色
D
饱和亚硫酸溶液
蓝色石蕊试液
②中溶液先变红又褪色
难度: 中等查看答案及解析
-
FeCl3、 CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,下列判断不正确的是
A.加人KSCN溶液一定不变红色
B.溶液中一定含Fe2+
C.溶液中一定不含Cu2+
D.剩余固体中一定含Cu
难度: 中等查看答案及解析
-
A、B、C、X均为中学化学常见的物质,它们之间有如下转化关系(其它产物已略去):
下列说法不正确的是
A.若A是NH3则C可能是氧化物
B.若A是非金属单质,则C与水反应的生成物为强酸
C.若X是金属单质,则B、C 中X的化合价可能是B>C
D.若X是强碱,则B可能是两性物质
难度: 中等查看答案及解析
-
汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3= K2O+5Na2O+16N2↑。若氧化产物比还原产物多1. 75 mol,则下列判断正确的是
A.生成40.0 L N2(标准状况)
B.有0. 250 mol KNO3被氧化
C.转移电子的物质的量为1. 75mol
D.被氧化的N原子的物质的量为3.75mol
难度: 中等查看答案及解析
-
含有下列各组离子的溶液中通入(或加入)过量的某种物质后仍能大量共存的是
A.H+、Ba2+、Fe3+、NO3-,通入SO2气体
B.Ca2+、Cl-、K+、H+,通入CO2气体
C.AlO2-、Na+、Br-、SO42-,通入CO2气体
D.HCO3-、Na+、I-、HS-,加入AlCl3溶液
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是
A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
B.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+4H2O
C.磁性氧化铁溶于稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O
D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:
2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓
难度: 中等查看答案及解析
-
从下列事实所列出的相应结论正确的是
实验事实
结论
A
Cl2的水溶液可以导电
Cl2是电解质
B
SO2通入硝酸钡溶液出现白色沉淀
BaSO3不溶于强酸
C
NaHCO3溶液与NaAlO2溶液混合产生白色沉淀
结合H+的能力:CO32-<AlO2-
D
常温下白磷可自燃,而氮气须在放电时才与氧气反应
非金属性:P>N
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温下,4 gCH4含有NA个C-H共价键
B. 1 mol Fe与足量稀HNO3反应,转移2NA个电子
C.1 L 0. 1 mol/L NaHCO3溶液中含有0. 1NA个HCO3-
D.常温常压下,22.4 LNO2和CO2的混合气体中含有2NA个氧原子
难度: 中等查看答案及解析
-
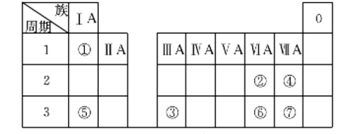
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2型分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L; W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.原子半径: W>Z>Y>X>M
B.XZ2、X2M2、W2Z2均为直线形的共价化合物
C.由X元素形成的单质不一定是导体
D.由 X、Y、Z、M四种元素形成的化合物一定既含有离子键,又含有共价键
难度: 中等查看答案及解析
-
下列各组物质的性质比较中,正确的是
A.酸性:HClO4>H3PO4>H2SO4
B.氢化物的稳定性:H2S>HF>H2O
C.碱性:Al(OH)3>Mg(OH)2>NaOH
D.氧化性:F2>C12>Br2>I2
难度: 简单查看答案及解析
-
将35.8 g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生6.72L气体(标准状况)。另取等质量的该合金溶于过量的稀硝酸中,生成13.44 LNO(标准状况),向反应后的溶液中加入足量的NaOH溶液,得到沉淀的质量为
A.66.4 g B.50.8 g C 44.8g D. 39.2 g
难度: 困难查看答案及解析
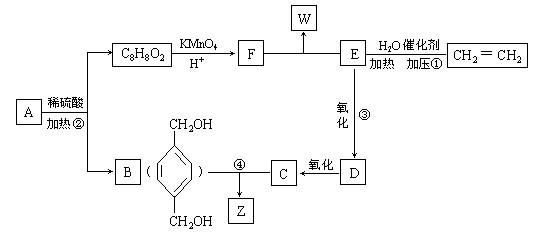
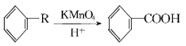 ,从A出发发生图示中的一系列反应,其中B和C按1:2反应生成Z。F和E按1:2反应生成W,W和Z互为同分异构体。
,从A出发发生图示中的一系列反应,其中B和C按1:2反应生成Z。F和E按1:2反应生成W,W和Z互为同分异构体。