-
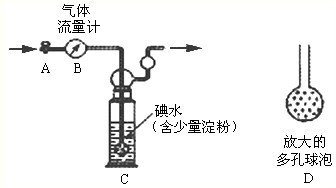
下列应用化学科学对物质进行研究的基本方法或所得的结论,不正确的是( )
A.焰色反应实验,若火焰呈黄色,不能确认是否含有钾元素
B.根据CO2和SiO2都是酸性氧化物,推知两者物理性质相似
C.根据电解质在水溶液中能否完全电离,将电解质分为强电解质与弱电解质
D.测定物质的量浓度相同的NaA和NaB溶液的PH,可以比较对应酸的酸性强弱难度: 中等查看答案及解析
-
亚硝酸(HNO2)及其钠盐参加反应时既可作氧化剂又可作还原剂.当它们作还原剂时,生成的含氮产物可能是( )
A.NO
B.N2
C.NO2
D.NH3难度: 中等查看答案及解析
-
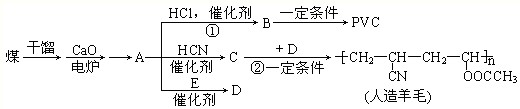
下列说法正确的是( )
A.汽油和植物油都是碳氢化合物
B.通过煤的干馏、液化和气化,可获得洁净的燃料
C.苯能与溴水发生取代反应而使其褪色
D.甲烷、乙烯和苯在工业上都可通过石油分馏得到难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+═2Fe3++2H2O
B.以石墨作电极电解氯化铝溶液:2Cl-+2H2O2OH-+H2↑+Cl2↑
C.浓烧碱溶液中加入铝片:Al+2OH-═AlO2-+H2↑
D.硫酸氢钠溶液与足量氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O难度: 中等查看答案及解析
-
下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液.相同条件下,有关上述溶液的比较中,正确的是( )
A.由水电离的C(H+):①=②>③=④
B.将②、③两种溶液混合后,若pH=7,则消耗溶液的体积:②>③
C.向等体积的四种溶液中分别加入100mL水后,溶液的pH:③>④>①>②
D.等体积的①、②、④溶液分别与铝粉反应,生成H2的量:②最大难度: 中等查看答案及解析
-
早在1807年化学家戴维用电解熔融氢氧化钠制得钠 4NaOH(熔)
4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH
Fe3O4+2H2↑十4Na↑.下列有关说法正确的是( )
A.电解熔融氢氧化钠制钠,阳极发生电极反应为:2OH--2e-=H2↑+O2↑
B.盖•吕萨克法制钠原理是利用铁的还原性比钠强
C.若戴维法与盖•吕萨克法制得等量的钠,则两反应中转移的电子总数也相同
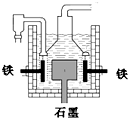
D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极难度: 中等查看答案及解析
-
反应mA(s)+nB(g)⇌pC(g)△H=-QkJ/mol在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )
①m+n>p;②x点表示该反应的正反应速率大于逆反应速率;
③n>p; ④x点时比y点时的反应速率慢.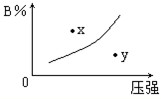
A.只有①
B.只有②④
C.只有①②④
D.只有①和③难度: 中等查看答案及解析