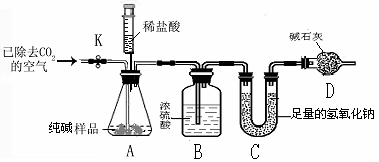
-
新修订的《环境空气质量标准》增加了PM2.5监测指标,PM2.5是指大气中直径小于或等于2.5微米的可吸入颗粒物。下列做法不会改变PM2.5检测结果的是
A.海水晒盐 B.燃放鞭炮 C.露天焚烧垃圾 D.工厂排放烟尘
难度: 简单查看答案及解析
-
儿童每日要摄取适量的钙,才能避免
A. 贫血症 B. 佝偻病 C. 夜盲症 D. 甲状腺肿大
难度: 简单查看答案及解析
-
下列说法错误的是
A.日常生活中用食盐作调味品
B.电池是将化学能直接转化为电能的装置
C.铁在潮湿的空气中不易生锈
D.洗洁精洗涤油腻的餐具发生乳化作用
难度: 简单查看答案及解析
-
下列实验基本操作正确的是
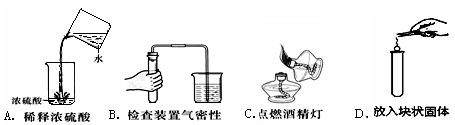
难度: 简单查看答案及解析
-
下列物质属于混合物的是
A.锌 B.石油 C.氧化镁 D.硝酸铵
难度: 简单查看答案及解析
-
野炊结束后,同学们及时用沙土盖灭火堆,其主要灭火原理是
A. 将可燃物与氧气隔离 B.撤离可燃物
C. 降低可燃物的着火点 D. 降低可燃物的温度
难度: 简单查看答案及解析
-
万金油的主要成分是薄荷脑(C10H10O),下列关于薄荷脑的说法错误的是
A.属于有机物
B.由碳、氢、氧三种元素组成
C.所含碳元素的质量分数为40%
D.1个分子由10个碳原子、10个氢原子和1个氧原子构成
难度: 简单查看答案及解析
-
以下是一个化学反应的微观示意图, 从示意图获取的信息正确的是
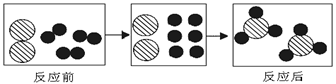
A.反应前后分子种类不发生改变
B.反应前后原子的种类与数目发生改变
C.反应前两种分子的个数比是1:2
D.该反应的基本类型是化合反应
难度: 简单查看答案及解析
-
下图表示的是甲、乙两种固体物质的溶解度曲线,下列叙述正确的是
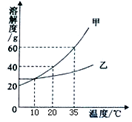
A.甲的溶解度大于乙的溶解度
B.35℃时100g甲的溶液中含甲的质量60g
C.降低温度可使接近饱和的甲溶液变成饱和溶液
D.10℃时甲、乙两种溶液的溶质质量分数一定相等
难度: 中等查看答案及解析
-
下列实验方法无法达到实验目的的是
A.用肥皂水鉴别硬水和软水
B.用燃着的木条鉴别氮气与二氧化碳
C.用熟石灰中和废液中的盐酸
D.用紫色石蕊试液鉴别稀硫酸和蒸馏水
难度: 简单查看答案及解析
-
几种作物适宜生长的pH范围如下表。取某地土壤浸出液,用pH试纸测得其显酸性。则这种土壤不适宜种植的作物是
作物
茶树
棉花
水稻
甘草
pH
5.0~5.5
6.0~6.8
6.0~7.0
7.2~8.5
A.水稻 B.棉花 C.茶树 D. 甘草
难度: 简单查看答案及解析
-
化学家创造出一种物质“干水”, 其每个颗粒含水95﹪,外层是SiO2 ,干水吸收二氧化碳的能力比普通清水高三倍。下列有关说法正确的是
A.干水和干冰是同一种物质
B.干水中的水分子不再运动
C.用干水吸收CO2有助于减缓温室效应
D.干水吸收CO2的过程只发生物理变化
难度: 简单查看答案及解析