-
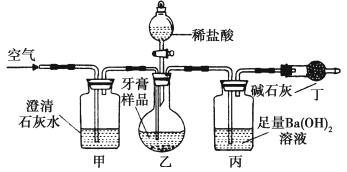
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )
A.氯水的颜色呈浅绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
难度: 中等查看答案及解析
-
化学实验设计或实际操作或储存时,能体现“经济、高效、环保、安全”方案是( )
A.Na 着火可以使用泡沫灭火器
B.绿色化学是指有毒气体尾气要经过无毒处理后在排放
C.实验室用浓硫酸溶解铜制备硫酸铜
D.实验室可以适当温度下,使铜片在持续通入空气的稀硫酸中溶解的方法制备硫酸铜
难度: 简单查看答案及解析
-
对下列化学用语或化学原理的理解和描述均正确的是( )
A.电子式
可以表示羟基,也可以表示氢氧根离子
B.比例模型
可以表示二氧化碳分子,也可以表示水分子
C.明矾能水解生成Al(OH)3胶体,可用作饮用水杀菌
D.原子结构示意图
可以表示12C,也可以表示14C
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的数值,下列说法正确的是( )
A. 标准状况下2.24L氯气与水充分反应转移电子数为0.1NA
B. 标况下,2.24LNO2分子总数小于0.1NA
C. 标准状况下2.24L的CCl4中含有的C—Cl键数为0.4NA
D. 6.8g液态KHSO4中含有0.1NA个阳离子
难度: 中等查看答案及解析
-
将适量的SO2通入Fe(NO3)3中,溶液逐渐由棕黄色变为浅绿色,但又立即变为棕黄色,继续滴入BaCl2溶液,产生白色沉淀。在上述一系列变化过程中,最终被还原的元素是
A.S B.Fe C.Cl D.N
难度: 中等查看答案及解析
-
下列反应的离子方程式中正确的是
A.碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-
NH3↑+H2O
B.Ca(HCO3)2溶液中滴加少量NaOH溶液 Ca2++HCO3-+OH-=CaCO3↓+H2O
C.NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性:
Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.向Fe(OH)2中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
难度: 困难查看答案及解析
-
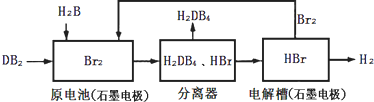
用下列装置不能达到有关实验目的的是( )
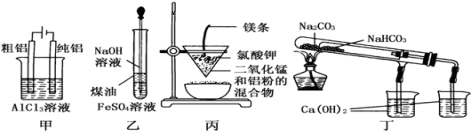
A.用甲图装置电解精炼铝
B.用乙图装置制备Fe(OH)2
C.用丙图装置可制得金属锰
D.用丁图装置验证NaHCO3和Na2CO3的热稳定性
难度: 中等查看答案及解析
-
在给定条件下,下列加线的物质在化学反应中几乎能被完全消耗的是
A.8.7g二氧化锰与50mL8mol·L-1浓盐酸共热制取氯气
B.19.2g铜与100mL12mol·L-1的硝酸反应
C.常温下,将5.4g铝片投入20mL18mol·L-1的硫酸中
D.将足量的Cu置于50mL18mol·L-1H2SO4溶液中加热
难度: 中等查看答案及解析
-
已知:C(s)+O2(g)=CO2(g) △H1 CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3 4Fe(s)+3O2(g)=2Fe2O3(s) △H4
3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是 ( )
A.△H1>0,△H3<0 B.△H2>0,△H4>0
C.△H1=△H2+△H3 D.△H3=△H4+△H5
难度: 中等查看答案及解析
-
中学化学常见物质甲、乙、丙、丁之间存在转化关系:甲+乙→丙+丁。下列说法正确的是( )
A.若甲为铜,丁为氯化亚铁,则乙一定是氯化铁
B.若甲为碳,丁为硅,则丙一定是二氧化碳
C.若甲为铝,丁为铁,则乙一定是氧化铁
D.若甲为镁,丁为氢气,则乙一定是酸
难度: 中等查看答案及解析
-
下列物质可通过化合反应一步得到的是( )
①FeCI3 ② FeCI2 ③ Fe(OH)3 ④ CuS
A.只有②③ B.只有①④ C.①②③④能得到 D.①②③能得到
难度: 中等查看答案及解析
-
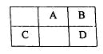
下列离子或分子组中,在相应的环境中能大量共存的是( )
选项
环境要求
离子
A
溶液中c(K+)<c(Cl-)
K+、AlO2-、Cl-、NO3-
B
溶液pH﹥7
Na+、S2-、K+、ClO-
C
水电离产生的c(H+)=10-12 mol/L的溶液
ClO-、CO32-、NH4+、NO3-、SO32-
D
向溶液中逐滴滴加烧碱溶液先有沉淀产生,后沉淀消失
Na+、Al3+、Cl-、SO42-
难度: 中等查看答案及解析
-
已知:2Fe + 3Br2=2FeBr3,Fe2+的还原性大于Br-。现有16.8 g铁和0.3 mol Br2反应后加入水得到澄清溶液后,通入a mol Cl2。下列叙述不正确的是
A.当a = 0.1时,发生的反应为2Fe2++Cl2=2Fe3++2Cl-
B.当a = 0.45时,发生的反应为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C.若溶液中Br-有一半被氧化时, c(Fe3+): c(Br-):c(Cl-) =1:1:3
D.当0<a<0.15时,溶液中始终满足2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(Br-)+ c(OH-)
难度: 困难查看答案及解析
-
下列各组物质相互混合反应后,既有气体生成,最终又有沉淀生成的是( )
①金属钠投入到FeCl3溶液中 ②过量Ba(OH)2浓溶液和AlNH4(SO4)2溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中 ④Na2O2投入FeCl2溶液中 ⑤Na2S2O3溶液中加入稀硫酸
A.只有①②④⑤ B.只有③ C.只有②③ D.只有①④⑤
难度: 中等查看答案及解析
-
常温下,向含有H2SO4的CuSO4溶液中逐滴加入含a mol溶质的NaOH溶液,恰好使溶液的pH=7,下列叙述错误的是( )
A.反应后溶液中c(Na+)=2c(SO) B.a/2 mol>沉淀的物质的量>0
C.沉淀的质量为49a g D.溶液中n(SO)=a/2 mol
难度: 中等查看答案及解析
-
已知NaCN溶液呈碱性;(CN)2与卤素单质的性质相似;CN-的还原性介于Br-、I-之间。下列变化不能发生的是
A.HCN
H++CN-
B.(CN)2+2Br-=2CN-+Br2
C.(CN)2 +CH2=CH2 → NC—CH2—CH2—CN
D.(CN)2 +2OH-=CN- +CNO- +H2O
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.中和热测定实验用的小烧杯和物质的量浓度溶液配制用的容量瓶都必须干燥
B.用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液终点时仰视读数,氢氧化钠浓度偏低
C.配制2.0 mol·L-1的硫酸,若定容时俯视,则所得溶液浓度偏高(其他操作均正确)
D.用铜电极电解2.0 mol·L-1的硫酸,阴阳两极生成气体的体积之比为2∶1
难度: 中等查看答案及解析
-
X、Y、Z、W、Q都是短周期元素,其中X原子的最外层电子数是内层电子数的3倍;X与Z同族,Y与Z同周期,Q原子的电子总数等于其电子层数的3倍,W与X、Y既不同族也不同周期且W不为稀有气体元素;X、Y、Z三种元素的族序数之和为16。下列说法正确的是( )
A.Q与W能形成10电子, 不能形成14电子、18电子分子
B.Y的最高价氧化物对应水化物的化学式只能表示为H4YO4
C.Y、Z、Q分别与X化合,只能形成AB2型化合物
D.X、Z、W三种元素形成的两种钠盐溶液发生化学反应生成的气体可使品红溶液褪色
难度: 中等查看答案及解析
-
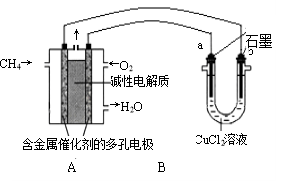
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:
CH3CH2OH-4e-+H2O=CH3COOH+4H+。下列有关说法不正确的是( )
A.检测时,电解质溶液中的H+向正极移动
B.若溶液中有0.4 mol电子通过,则在标准状况下消耗4.48 L氧气
C.电池反应的化学方程式为:CH3CH2OH+O2==CH3COOH+H2O
D.正极上发生的反应为:O2+4e-+4H+=2H2O
难度: 中等查看答案及解析
-
8.34 g FeSO4·7H2O样品在隔绝空气条件下受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示。下列说法中正确的是( )
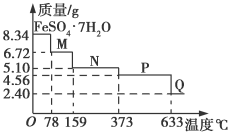
A.温度为78℃时固体物质M的化学式为FeSO4·5H2O
B.温度为159℃时固体物质N的化学式为FeSO4·3H2O
C.在隔绝空气条件下由N得到P的化学方程式为FeSO4
FeO+SO3↑
D.取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3
难度: 极难查看答案及解析
-
在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)
zC(g),达到平衡时,测得A的浓度为0.5 mol/L,在温度不变的条件下,将容器的体积扩大到两倍,使再达到平衡,测的A的浓度降低为0.3 mol/L,下列有关判断正确的是( )
A.x+y<z B.平衡向正反应方向移动
C.C的体积分数下降 D.B的浓度增大
难度: 中等查看答案及解析