-
化学与生产生活、环境保护密切相关.下列说法中不正确的是
A.铁表面镀锌可增强其抗腐蚀性
B.漂白粉的有效成分是CaCl2和Ca(ClO)2
C.氢氧化铝是治疗胃酸过多的药物的有效成分之一
D.“煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾天气
难度: 中等查看答案及解析
-
下列说法正确的是
A.在101kPa时,1molC与适量O2反应生成1molCO时,放出110.5kJ热量,则C的燃烧热为110.5kJ/mol
B.在101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ热量,H2燃烧热为
—285.8kJ/mol
C.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度
D.在稀溶液中:H+(aq) + OH--(aq) === H2O(l);△H= —57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ
难度: 中等查看答案及解析
-
以下现象与电化学腐蚀无关的是( )
A. 黄铜(铜锌合金)制作的铜锣不易产生铜绿
B. 生铁比纯铁容易生锈
C. 铁质器件附有铜质配件,在接触处易生铁锈
D. 银质物品久置表面变暗
难度: 简单查看答案及解析
-
120mL含有0.20mol/L碳酸钠溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A. 1.2 mol/L B. 2.0mol/L C. 0.18 mol/L D. 0.24mol/L
难度: 困难查看答案及解析
-
下列过程中,一定需要通电才能实现的是
A.电解质电离 B.电化学防腐
C.蓄电池放电 D.电解精炼铜
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 标准状况下,11.2 L苯含有的分子数为0.5NA
B. 3.2 g CH4含有的化学键数为0.4NA
C. 足量的O2与1 mol Na充分反应,转移的电子数为NA
D. 25 ℃时,1.0 L pH=13的Ba(OH)2溶液中含有的OH-数为0.2NA
难度: 中等查看答案及解析
-
7瓶分别含有Cu2+、Fe3+、Al3+、Mg2+、Fe2+、NH
、Na+等离子的溶液,只用一种试剂即可鉴别,该试剂是( )
A. KMnO4溶液 B. KSCN溶液 C. NaOH溶液 D. NH3·H2O溶液
难度: 中等查看答案及解析
-
在下列给定条件的溶液中,一定能大量共存的离子组是( )
A. 使pH试纸显深蓝色的溶液:Ca2+、NH
、HCO
、Cl-
B. 室温下,KW/c(H+)=0.1 mol·L-1的溶液:Na+、K+、SiO
、NO
C. 含FeCl2的溶液:K+、Na+、SO
、AlO
D. 能与金属铝反应放出氢气的溶液:Mg2+、Na+、SO
、Cl-
难度: 困难查看答案及解析
-
下列各组物质能满足如图所示转化关系的是(图中箭头表示一步转化)( )
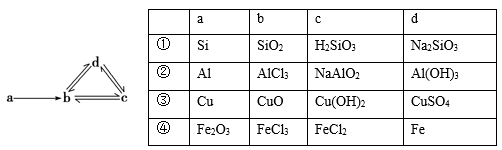
A. ①② B. ②③ C. ③④ D. ②④
难度: 中等查看答案及解析
-
R、X、Y、Z均是短周期主族元素,X、Y、Z处于同一周期,R、X、Z的简单离子具有相同的电子层结构,R的最高价氧化物对应的水化物与其氢化物能反应生成盐,X的氧化物既能溶于强酸又能溶于强碱,Y的最高正价与最低负价的代数和为0。下列说法错误的是( )
A. 最高价氧化物对应的水化物酸性:R>Y B. 原子半径:Z>X>Y
C. 金属单质的活动性:Z>X D. 最高正价:Z>R>X
难度: 中等查看答案及解析
-
X、Y、Z为短周期主族元素,X的最外层电子数为内层电子数的2倍,Y的最高化合价与最低化合价的代数和为4,Z与Y同周期,Z的原子半径小于Y。下列叙述不正确的是( )
A. Z的氢化物是同主族简单氢化物中沸点最低的一种
B. 非金属性:Z>Y>X
C. XY2中各原子最外层均满足8电子结构
D. X、Y、Z的氢化物中化学键均为极性共价键
难度: 中等查看答案及解析
-
X、Y、Z、W、R是原子序数依次增大的五种短周期元素,化合物XZ、Y2W能破坏水的电离平衡,XR能抑制水的电离,则Y元素为
A.Li B.F C.Na D.S
难度: 中等查看答案及解析
-
R、X、Y、Z、A是短周期主族元素,它们在周期表中的相对位置如图所示。X原子最外层电子 数等于其电子层数的3倍。下列推断正确的是( )
R
X
Y
Z
A
A. 气态氢化物的热稳定性由强到弱的顺序为:Z>R>X>Y
B. 原子半径由小到大的顺序为:Z<A<Y<X
C. 最高价氧化物对应的水化物酸性由弱到强的顺序为:Z<R<A
D. RY3、A2X、ZA5分子中每个原子最外层都达到8电子结构
难度: 中等查看答案及解析
-
下列操作正确且能达到实验目的的是( )
A.
 验证化学能转化为电能 B.
验证化学能转化为电能 B.  制备无水氯化镁
制备无水氯化镁C.
 制备Fe(OH)2 D.
制备Fe(OH)2 D. 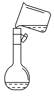 配制一定物质的量浓度的溶液
配制一定物质的量浓度的溶液难度: 中等查看答案及解析
-
高铁电池是一种可逆电池,该电池能长时间保持稳定的放电电压。高铁电池总反应为3Zn+2K2FeO4+8H20
3Zn(OH)2+2Fe(OH)3+4KOH。下列判断不正确的是
A.放电时,负极反应为Zn-2e-+2OH一=Zn(OH)2
B.充电时,阴极pH增大
C.放电时,若有6mol电子转移,则正极有10 mol OH一移向负极
D.充电时,阳极反应为Fe(OH)3+5OH一+3e一=FeO42-+4H2O
难度: 简单查看答案及解析
-
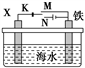
下列与金属腐蚀有关的说法正确的是( )
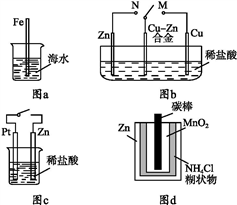
A. 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B. 图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C. 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D. 图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
①将金属Na投入水中:2Na+2H2O=2Na++2OH-+H2↑
②在硫酸溶液中加入氢氧化钡溶液至中性:Ba2++OH-+H++SO2-4=BaSO4↓+H2O
③碳酸氢钠溶液中滴加盐酸:HCO3-+H+=CO2↑+H2O
④氢氧化钠中滴加醋酸:OH-+H+=H2O
A. ①③④ B. ①③ C. ②④ D. ①②③
难度: 中等查看答案及解析
-
有甲、乙、丙三种溶液,进行如下操作:

则甲、乙、丙三种溶液可能是( )
A. BaCl2、H2SO4、MgCl2 B. CaCl2、HNO3、AgNO3
C. CaCl2、HNO3、NaCl D. BaCl2、HCl、NaNO3
难度: 中等查看答案及解析
-
热激活电池可用作火箭、导弹的工作电源。该电池以Ca为负极,熔融无水LiClKCl混合物作电解质,结构如图所示。正极反应式为PbSO4+2Li++2e-===Li2SO4+Pb。下列说法不正确的是( )
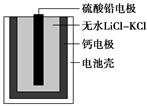
A. 放电过程中,Li+向正极移动
B. 常温下电解质是不导电的固体,电池不工作
C. 每转移0.1 mol电子,理论上生成20.7 g Pb
D. 该电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb
难度: 中等查看答案及解析
-
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族,X+与M2-具有相同的电子层结构,离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是( )
A. X、M两种元素只能形成X2M型化合物
B. 由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低
C. 元素Y、Z、W的单质晶体属于同种类型的晶体
D. 元素W和M的某些单质可作为水处理的消毒剂
难度: 中等查看答案及解析
-
已知w g液态苯(C6H6)完全燃烧生成2 mol CO2气体和1 mol液态水,并放出m kJ的热量,下列能正确表示苯燃烧热的热化学方程式的是( )
A. 2C6H6(l)+15O2(g)===12CO2(g)+6H2O(l) ΔH=-2m kJ·mol-1
B.
C6H6(l)+
O2(g)===2CO2(g)+H2O(l) ΔH=-m kJ·mol-1
C. C6H6(l)+
O2(g)===6CO2(g)+3H2O(l) ΔH=-m kJ·mol-1
D. C6H6(l)+
O2(g)===6CO2(g)+3H2O(l) ΔH=-3m kJ·mol-1
难度: 简单查看答案及解析
-
右图为1molSO2Cl2(g)和1molSCl2(g)反应生成SOCl2(g)能量变化的示意图,已知E1=xkJ/mol,E2=ykJ/mol,下列有关说法正确的是( )
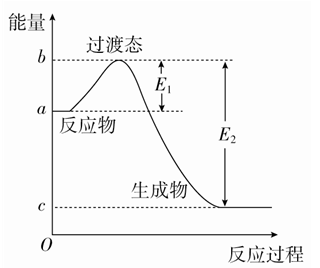
A. 若在反应体系中加人催化剂,E1不变
B. 若在反应体系中加入催化剂,△H减小
C. 反应的活化能等于y kJ•mol-1
D. 1 mol SO2Cl2(g)和1 mol SCl2(g)反应生成SOCl2(g)的△H=(x-y) kJ•mol-1
难度: 中等查看答案及解析
-
H2和I2在一定条件下能发生反应:H2(g)+I2(g)
2HI(g) ΔH=-a kJ·mol-1
已知:
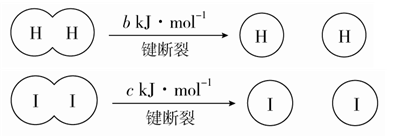
(a、b、c均大于零)
下列说法不正确的是
A. 反应物的总能量高于生成物的总能量
B. 断开1 mol H—H键和1 mol I—I键所需能量大于断开2 mol H—I键所需能量
C. 断开2 mol H—I键所需能量约为(c+b+a)kJ
D. 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
难度: 中等查看答案及解析
-
向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A. Cu与Cu2O 的物质的量之比为2:1
B. 硝酸的物质的量浓度为2.6mol/L
C. 产生的NO在标准状况下的体积为4.48L
D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
难度: 困难查看答案及解析
-
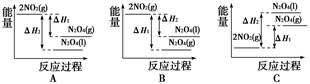
化学反应N2+3H2
2NH3的能量变化如图所示,该反应的热化学方程式是( )
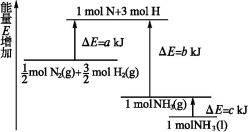
A.N2(g)+3H2(g)
2NH3(l) ΔH=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g)
2NH3(g) ΔH=2(b-a)kJ·mol-1
C.N2(g)+H2(g)
NH3(l) ΔH=(b+c-a)kJ·mol-1
D.N2(g)+H2(g)
NH3(g) ΔH=(a+b)kJ·mol-1
难度: 中等查看答案及解析