-
甲、乙、丙、丁、戊五种溶液的溶质分别是HCl、CH3COOH、NaOH、NH3•H2O、Na2CO3中的一种. 常温下如下实验:
①将0.1L pH=9的甲溶液分别与a L 0.001mol/L的乙溶液、b L 0.001mol/L的丁溶液充分反应后溶液呈中性时,a>b;
②浓度均为0.1mol/L的丙和丁溶液等体积混合后,溶液呈酸性;
③0.1mol/L的甲溶液pH小于0.1mol/L的戊溶液pH.
下列判断正确的是( )
A.甲的溶质是NH3•H2O
B.乙的溶质是CH3COOH
C.丙的溶质是NaOH
D.戊的溶质是HCl难度: 中等查看答案及解析
-
2011年为国际化学年,主题为“化学-我们的生活,我们的未来”. 下列说法错误的是( )
A.化学是一门以实验为基础的自然科学
B.化学是在原子、分子水平上研究物质的科学
C.绿色化学的核心是应用化学原理对环境污染进行治理
D.化学是生命科学、材料科学、能源科学等的重要基础难度: 中等查看答案及解析
-
下列实验操作正确的是( )
A.测定某浓度盐酸的pH时,先将pH试纸用蒸馏水湿润
B.蒸馏时,将温度计的水银球插入蒸馏烧瓶中液面以下
C.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.中和滴定时,锥形瓶必须洗净并烘干后才能使用难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.4.6gNO2和N2O4中含有的原子数为0.3NA
B.1L0.1mol/L的硫酸铜溶液中含铜离子数为0.1NA
C.0.1mol18O原子中含有的中子数为0.9NA
D.33.6L氯气与足量的铁充分反应,转移的电子数为3NA难度: 中等查看答案及解析
-
一定条件下,可逆反应:N2(g)+3H2(g)
2NH3(g);△H<0,达到化学平衡后,改变某一条件时,下列说法错误的是( )
A.加入催化剂,v(正)、v(逆)都发生变化,且变化的倍数相等
B.降低温度,v(正)、v(逆)都减小,且v(正)减小倍数小于v(逆)减小倍数
C.增大压强,v(正)、v(逆)都增大,且
D.通入氩气,v(正)、v(逆)都增大,且v(正)增大倍数小于v(逆)增大倍数难度: 中等查看答案及解析
-
已知瘦肉精(盐酸克伦特罗)的结构简式如图,下列有关说法不正确的是( )
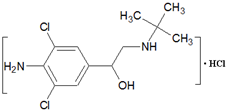
A.处于同一平面上的原子最多有10个
B.瘦肉精属于芳香族化合物
C.瘦肉精一定条件下能发生消去反应
D.瘦肉精的化学式为C12H19Cl3N2O难度: 中等查看答案及解析
-
下表是部分短周期元素的原子半径及主要化合价.
以下叙述正确的是( )元素代号 L M Q R T 原子半径/nm 0.160 0.143 0.112 0.104 0.066 主要化合价 +2 +3 +2 +6、-2 -2
A.气态氢化物的稳定性为H2T<H2R
B.M和T能形成一种极有前途的高温结构陶瓷
C.单质与稀盐酸反应的速率为L<Q
D.L2+与R2-的核外电子数相等难度: 中等查看答案及解析
-
如图所示,下列说法正确的是( )
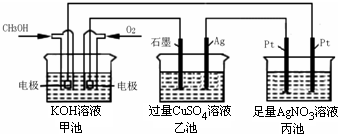
A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B.甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O=CO32-+8H+
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使溶液恢复到原浓度
D.甲池中消耗224mL(标准状况下)O2,此时丙池中理论上最多产生4.32g固体难度: 中等查看答案及解析