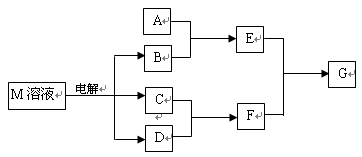
-
提出元素周期律并根据周期律编制第一个元素周期表的科学家是
A.道尔顿 B.普利斯特里 C.门捷列夫 D.阿佛加德罗
难度: 简单查看答案及解析
-
某粒子含有6个质子,7个中子,电荷为0,则它的化学符号是
A. 13Al B.13Al C.13 C D. 13C
难度: 简单查看答案及解析
-
对于A ZX 和A+1 ZX+ 两种粒子,下列叙述正确的是
A.质子数一定相同,质量数和中子数一定不同
B.化学性质几乎相同
C.一定都由质子、中子、电子构成
D.核电荷数,核外电子数一定相同
难度: 简单查看答案及解析
-
下列物质中阳离子半径与阴离子半径比值最小的是
A.NaCl B.LiF C.LiCl D.KF
难度: 简单查看答案及解析
-
下列叙述中错误的是
A.原子半径:Cl>S>O B.还原性:Na>Mg>Al
C.稳定性:HF>HCl>HBr D.酸性:HClO4>H2SO4>H3PO4
难度: 简单查看答案及解析
-
下列各组元素性质递变情况错误的是
A.Li、Be、B原子最外层电子数逐渐增多 B.N、O、F原子半径依次增大
C.P、S、Cl最高正价依次升高 D.Li、Na、K、Rb的金属性依次增强
难度: 简单查看答案及解析
-
下列说法正确的是
A.SiH4比CH4稳定
B.O2-半径比F-的小
C.Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强
D.P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱
难度: 简单查看答案及解析
-
下列说法中,正确的是
A.所有主族元素正化合价数等于它的族序数
B.VIIA族元素的原子随核电荷数的增加,得电子能力逐渐减弱
C.IA、IIA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
D.前三周期元素中共有12种非金属元素(包括稀有气体元素)
难度: 简单查看答案及解析
-
对于下列有关金属钠的叙述中,正确的是
A.由于钠比较活泼,所以它能从溶液中置换出金属活动顺序表钠后面的金属
B.1个钠原子能失去1个电子,1个镁原子能失去2个电子,所以镁的还原性比钠强
C.钠能把钛、锆等金属从熔融卤化物里还原出来
D.0.5L 1mol/L的盐酸分别与 1mol钠、镁、铝反应,所生成的氢气的量相等
难度: 简单查看答案及解析
-
下列关于元素化合价的叙述中错误的是
A.ⅢA族的B和Al都能形成+3价的化合物
B.ⅣA族的C和Si都能形成+4价的化合物
C.ⅤA族的N和P都能形成+5价的化合物
D.ⅥA族的O和S都能形成+6价的化合物
难度: 简单查看答案及解析
-
下列装修材料的主要成分不属于硅酸盐的是
A.陶瓷 B.大理石 C.玻璃 D.水泥
难度: 简单查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。如Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是
A.W单质能与水反应,生成一种具有漂白性的物质
B.原子半径:W﹥Z﹥Y﹥X
C.4种元素的单质中,Z单质的熔、沸点最低
D.最高价氧化物对应水化物的酸性:Z﹥W﹥X
难度: 简单查看答案及解析
-
自来水常用Cl2消毒,若用这种自来水去配制下列物质的溶液,不会产生明显的药品变质问题的是
A.Na2CO3 B.FeCl2 C.AgNO3 D.AlCl3
难度: 简单查看答案及解析
-
向某溶液中投入铝片后有大量H2放出,则溶液中不可能大量存在的离子是
A.Cl- B.H+ C.HCO3- D.OH-
难度: 简单查看答案及解析
-
X元素的阳离子与Y元素的阴离子具有相同的电子层结构,下列叙述正确的是
A.原子序数X<Y B.原子半径X<Y
C.离子半径X>Y D.原子最外层电子数X<Y
难度: 简单查看答案及解析
-
某元素最高价氧化物对应水化物的化学式是H3XO4,该元素的气态氢化物的化学式是
A.H2X B.HX C.XH3 D.XH4
难度: 简单查看答案及解析
-
氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的是
A.35Cl原子所含质子数为18
B.1/18mol的1H35Cl分子所含中子数约为6.02×1023
C.3.5g35Cl2气体的体积约为22.4L
D.35Cl2气体的摩尔质量为70g
难度: 简单查看答案及解析
-
卤素(从氟到碘)原子半径的增大,下列递变规律正确的是
A.单质的密度逐渐减小,颜色逐渐加深,熔、沸点逐渐降低
B.单质的氧化性逐渐增强
C.卤素离子的还原性逐渐增强
D.气态氢化物的稳定性逐渐增强
难度: 简单查看答案及解析
-
砹是原子序数最大的卤族元素,推测砹或砹的化合物最不可能具有的性质是
①砹化氢很稳定 ②砹单质与水反应,砹全部转化成氢砹酸和次砹酸 ③砹是黑色固体 ④砹化银难溶于水 ⑤ 砹易溶于某些有机溶剂
A.只有①② B.只有①③④ C.只有③④⑤ D.只有②④⑤
难度: 简单查看答案及解析
-
可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法是
A.加热时有无气体放出
B.滴加盐酸时有无气泡放出
C.溶于水后滴加澄清石灰水,有白色沉淀生成
D.溶于水后滴加BaCl2稀溶液,有白色沉淀生成
难度: 简单查看答案及解析
-
下列离子方程式不正确的是
A.氟气通入与氯化钠溶液中: F2 + 2Cl-══ 2F- + Cl2
B.二氧化硅与NaOH溶液反应:SiO2+2OH―══SiO32—+H2O
C.铝粉加入稀盐酸中:2Al+6H+══2Al3++3H2↑
D.铝粉加入KOH溶液中:2Al+2OH―+6H2O══2[Al(OH)4]―+3H2↑
难度: 简单查看答案及解析
-
若甲、丙为短周期、同一主族元素组成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如下图所示的转化关系,则满足条件的甲和丙可以为
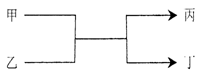
A.钠和氧气 B.硫和氧气
C.碳和硅 D.氯气和溴
难度: 简单查看答案及解析