-
酸雨给人类带来了种种灾祸,严重地威胁着地球生命生存的生态环境,下列有关减少或者防止酸雨形成的措施中可行的是
①将煤液化或气化,获得清洁燃料;②对含SO2、NO2等工业废气进行无害处理后,再排放到大气中;③人工收集雷电作用所产生的氮的氧化物;④飞机、汽车等交通工具采用新能源,比如氢能
A.①②③④ B.①②③ C.①②④ D.①③④
难度: 中等查看答案及解析
-
绿色化学的最大特点在于它是在始端就采用实现污染预防的科学手段,因而过程和终端均为零排放或零污染。绿色化学主张在通过化学转换获取新物质的过程中充分利用每个原子,具有“原子经济性”,因此它既能够充分利用资源,又能够防止污染,下列化学反应,不符合绿色化学概念的是
A.消除硫酸厂尾气排放:SO2+NH3+H2O=(NH4)2SO3
B.消除制硝酸工业尾气的氮氧化物污染:NO2+NO+NaOH=2NaNO2+H2O
C.制CuSO4 :Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
D.工业制乙醇 :
难度: 中等查看答案及解析
-
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是
A.原子核内有10个中子的氧原子:18O B.乙烯的结构简式: CH2CH2
C.CH4 分子的比例模型:
D.-CH3(甲基)的电子式为:
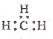
难度: 中等查看答案及解析
-
下列化学式可以表示一种物质的是
A.C2H6O B.C C.C3H8 D.P
难度: 中等查看答案及解析
-
下列各组物质,化学键类型相同、晶体类型也相同的是
A.SO2和
B. CCl4和KCl C.NaCl和HCl D.CO2和H2S
难度: 中等查看答案及解析
-
下列物质中,所含的原子或离子中最外层都为8电子结构的是
A.NO2 B.K2S C.LiCl D.CHCl3
难度: 中等查看答案及解析
-
下列说法不正确的是
A.乙烯、苯、溴苯分子中的所有原子均共平面
B.水加热至1000℃以上才分解是因为水分子间存在着氢键
C.常温下浓硫酸和浓硝酸能使铝发生钝化,所以可以用铝槽罐车运输浓硫酸、浓硝酸
D.能发生银镜反应的有机物结构中一定含有-CHO
难度: 中等查看答案及解析
-
下表为某有机物与各种试剂反应的现象,则这种有机物可能是
试剂
钠
溴水
NaHCO3
现象
放出气体
褪色
无气体放出
A.CH2=CH—COOH B.CH2=CH—CH3 C.CH3COOCH2CH3 D.CH2=CH—CH2—OH
难度: 中等查看答案及解析
-
下列反应的化学方程式或离子方程正确的是
A.CH3CH=CH2发生加聚反应:
B.乙酸乙酯在酸性条件下水【解析】
C.SO2通入到BaCl2溶液中:SO2+ Ba2++H2O= BaSO3↓+2H+
D.Fe(NO3)2溶液中滴加稀盐酸:3Fe2++4H++NO3- = 3Fe3++NO↑+2H2O
难度: 中等查看答案及解析
-
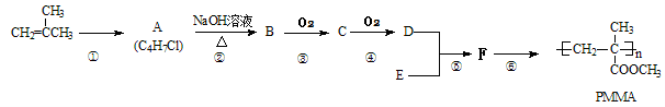
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。下列说法正确的是
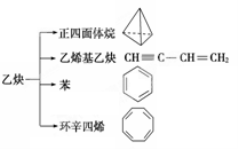
A.正四面体烷的分子式为C4H4,其二氯代物有两种
B.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量相同
C.苯为平面六边形结构,分子中存在C—C和C==C,能使酸性KMnO4溶液褪色
D.环辛四烯跟苯的结构很像,不能使溴水褪色
难度: 中等查看答案及解析
-
下列叙述不正确的是
A.NH3易液化,液氨常用作制冷剂
B.与铜反应时,浓硝酸被还原成NO2而稀HNO3被还原成NO,所以稀HNO3氧化性强于浓HNO3
C.氨盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处
D.氨水逐滴滴加到硝酸银溶液中,先出现沉淀,后沉淀溶解
难度: 中等查看答案及解析
-
X、Y代表两组概念,其关系如下图,下列选项不满足相应关系的是
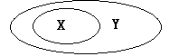
选项
X
Y
A.
氢键
化学键
B.
SO2
漂白性物质
C.
油脂
酯
D.
置换反应
氧化还原反应
难度: 中等查看答案及解析
-
已知短周期主族元素A、B在周期表中的相对位置如右图(稀有气体除外),则下列说法不正确的是
A
B
A.A一定是第2周期元素 B.B的原子半径一定比A大
C.B的金属性一定比A强 D.A的熔沸点一定比B高
难度: 中等查看答案及解析
-
以下是1-18号元素某性质的递变规律,Y轴代表的是
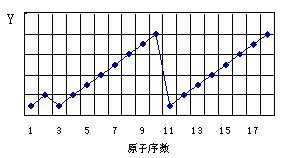
A.原子半径 B.金属性 C.非金属性 D.最外层电子数
难度: 中等查看答案及解析
-
下列除杂所用的试剂与方法都正确的是
A.除去NO中混有的NO2:水、洗气
B.除去乙酸乙酯中混有的少量乙酸:氢氧化钠溶液、分液
C.除去乙醇中的少量水:金属钠、蒸馏
D.除去二氧化硫中混有的少量二氧化碳:澄清石灰水、洗气
难度: 中等查看答案及解析
-
设阿伏加德罗常数的值为NA,则下列说法正确的是
A.标准状况下,11.2L CCl4所含的分子数为0.5NA
B.常温常压下,4.2g C2H4和C8H16的混合物中含有的碳原子数为0.3NA
C.7.8g苯分子中碳碳双键的数目为0.3 NA
D.6.4gCu与20mL10 mol·L-1浓硫酸反应,转移的电子数为0.2NA
难度: 中等查看答案及解析
-
下列实验能达到目的的是
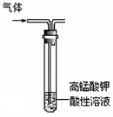


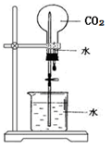
A.除去乙烷中混有的乙烯 B.石油蒸馏 C.乙醇催化氧化 D.CO2喷泉实验
难度: 中等查看答案及解析
-
下列各组顺序的排列不正确的是
A.原子半径:Na>Mg>Al B.热稳定性:HCl> H2S>PH3
C.还原性:I–<Br–<Cl– D.熔点:金刚石>食盐>干冰
难度: 简单查看答案及解析
-
有机物A的分子式为C6H12O2,在一定条件下发生如下转化关系,且D和E都不能发生银镜反应,由此推断A的可能结构有:
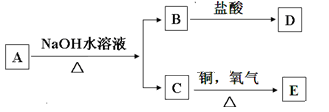
A.6种 B.4种 C.3种 D.2种
难度: 中等查看答案及解析
-
为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分中含有NH4+、Fe2+、SO42-和H2O,下列实验叙述中不正确的是
A.取少量样品放入试管中,加热,试管口放一团蘸有无水硫酸铜粉末的棉花团,变蓝则可证明晶体的成分中含有结晶水
B.取少量样品溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+
C.取少量样品溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42-
D.取少量样品放入试管中,加入少量稀NaOH溶液,在试管口用湿润的红色石蕊试纸检验,则可证明晶体的成分中是否含有NH4+
难度: 中等查看答案及解析
-
下列各组物质中,不管它们以何种比例混合,只要总物质的量一定,充分燃烧后消耗氧气的量一定的是
A.C2H2和C6H6 B.C2H6O和C3H6O2 C.CH2O和C2H4O2 D.C3H8和C4H8O2
难度: 中等查看答案及解析
-
有机物的化学性质主要由其官能团决定。苹果酸是一种有机酸,结构简式为:
。下列有关苹果酸的说法不正确的是
A.1mol苹果酸足量金属钠反应,生成氢气3g
B.1mol苹果酸与足量氢氧化钠溶液反应,消耗3 mol氢氧化钠
C.1mol苹果酸能与足量的碳酸氢钠溶液反应,标况下生成44.8L的二氧化碳气体
D.苹果酸在一定条件下既能与醋酸反应,又能与乙醇反应,也可以自身发生酯化反应
难度: 中等查看答案及解析